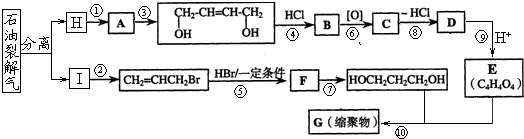
-
有同学在化学学习中自己总结了以下四个结论,你认为不正确的是( )
A.化学反应中原子团可重新组合、也可以破裂,爆炸过程中一定伴随着化学反应
B.要降低温室气体排放量的关健之一就是能源问题,大办推广氢能、核能、风能、生物质能、太阳能等都可有利于实行“低碳”
C.氮的固定过程中必定发生氧化还原反应.合成氨、化石燃料燃烧等都是氮固定的重要途径,都会影响自然界中的氮循环平衡
D.化学家合成和分离了超过4500万种物质基础.化学合成和分离技术为信息技术、生物技术、航空航天技术等奠定了物质基础难度: 中等查看答案及解析
-
X是一种天然有机物,其结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是重要有机合成原料.下列关于物质X的说法正确的是( )
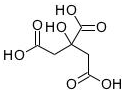
A.X分子式C6H7O7,且分子内所有原子均可能在同一平面上
B.1mol物质X可以和3mol氢气发生加成
C.1H核磁共振谱可证明X分子有4种化学环境不同的氢原子
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体相同难度: 中等查看答案及解析
-
一元弱酸HA(aq)中存在下列电离平衡:HA
H++A-,如图将1.0mol HA分子加入1.0L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
已知W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,下列有关说法正确的是( )
W X Y Z
A.Y的化学活泼性一定比W强
B.Y元素的原子半径可能比X元素的小
C.Z的气态氢化物的稳定性一定比X的强
D.Z的原子序数可能是X的原子序数的2倍难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.在Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.碳铵溶液中加入过量的NaOH溶液并共热:NH4++OH-=NH3↑+H2O
C.向偏铝酸钠溶液中滴加少量盐酸:AlO2-+H++H2O=Al(OH)3↓
D.溶液中通入CO2:2
+CO2+H2O→2
+CO32-
难度: 中等查看答案及解析
-
2009年12月7日长安汽车宣布,首款纯电动汽车试生产正式下线.电动汽车电池有LiFePO4电池和高铁电池,已知LiFePO4电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,导电固体为电解质.高铁酸钾-锌电池反应:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
下列有关电动汽车电池说法正确的是( )
A.高铁电池放电时每转移3mol电子,正极有1molK2FeO4被氧化
B.高铁电池放电时电池内部FeO42-向正极移动
C.LiFePO4电池充电过程中,电池正极材料的质量保持不变
D.LiFePO4电池放电时电池正极反应为:FePO4+Li++e-→LiFePO4难度: 中等查看答案及解析
-
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满Cl2的试管是( )
A.
B.
C.
D.难度: 中等查看答案及解析