-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. NA个氧分子与NA个氢分子的质量之比为8∶1
B. 100 mL 1.0 mol·L-1FeCl3溶液与足量Cu反应,转移的电子数为0.2NA
C. 标准状况下,11.2 L CCl4中含有C—Cl键的数目为2NA
D. NA个D2O分子中,含有10NA个电子
难度: 中等查看答案及解析
-
下列属于碱性
氧化物的是( )
A. CO B. MgO C. SO3 D. Ca(OH)2
难度: 简单查看答案及解析
-
下列物质属于电解质且能导电的是( )
A. 铜 B. 熔融的硝酸钾
C. 氢氧化钠溶液 D. 氯化氢
难度: 简单查看答案及解析
-
下图所示是分离混合物时常用的仪器,从左至右,对应的混合物分离操作方法正确的是( )
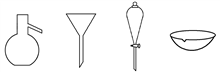
A. 蒸馏、蒸发、分液、过滤 B. 蒸馏
、过滤、分液、蒸发
C. 分液、过滤、蒸馏、蒸发 D. 过滤、蒸发、分液、蒸馏
难度: 简单查看答案及解析
-
下列反应的反应物中,第ⅣA族元素的氧化物作为氧化剂的是( )
A. Na2CO3+SiO2
Na2SiO3+CO2↑
B. CO+H2O
CO2+H2
C. CO2+2NaOH===Na2CO3+H2O
D. CO+2H2
CH3OH
难度: 简单查看答案及解析
-
下列物质的水溶液中,因水解呈酸性的是( )
A. CH3COONa B. HNO3
C. NaHSO4 D.
KAl(SO4)2
难度: 中等查看答案及解析
-
H2是一种很有前景的能源,以水为原料大量制取H2,最理想的途径是( )
A. 在光分解催化剂存在下,利用太阳能分解水制H2
B. 以焦炭和水为原料制水煤气后再分离出H2
C. 以金属钠与水反应生成H2
D. 由热电站提供电力电解水产生H2
难度: 简单查看答案及解析
-
下列化学用语中,正确的是( )
A. Mg原子结构示意图:
B. NaCl的电子式:
C. CO2分子的结构式:O—C—O
D. 乙烯的结构简式:CH2CH2
难度: 简单查看答案及解析
-
下列物质制备与工业生产相符的是( )
A. 浓盐酸
Cl2
漂白粉
B. MgCl2溶液
无水MgCl2
Mg
C. FeS2
SO2
H2SO4
D. 饱和NaCl溶液
NaHCO3悬浊液
 Na2CO3
Na2CO3难度: 困难查看答案及解析
-
下列基本实验操作不正确的是( )
编号
①
②
③
④
操作示
意图
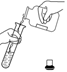
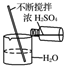
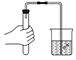
操作
名称
倾倒
液体
取用块
状固体
稀释浓
硫酸
检查气
密性
A. ①③ B. ①②
C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列有关氯及其化合物的说法不正确的是( )
A. 氯气能溶于水,常温常压下,1体积水约能溶解2体积氯气
B. 漂白粉主要成分为Ca(ClO)2和CaCl2,可用于漂白纸浆
C. 氯气可用于自来水的消毒、农药的生产、药物的合成
D. 海水中的氯化物含量相当高,因此氯被称为“海洋元素”
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.
C和
C是碳元素的2种核素,它们互为同位素
B. 化学研究者开发出被称为第五形态的固体碳,这种新的碳结
构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与C60互称同素异形体
C.
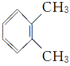 与
与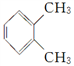 互为同分异构体
互为同分异构体D. 硝基苯可看成是由
和—NO2两种基团组成
难度: 简单查看答案及解析
-
能说明可逆反应N2(g)+O2(g)
2NO(g)已达到平衡状态的是( )
A. 混合气体的平均相对分子质量维持不变
B. 容器内始终有N2、O2和NO共存
C. 容器内反应混合物的总物质的量不随时间改变
D. 2v正(N2)=v逆(NO)
难度: 简单查看答案及解析
-
下列离子反应方程式不正确的是( )
A. 硫酸型酸雨的形成会涉及反应:2H2SO3+O2===4H++2SO
B. 热的纯碱溶液可以清洗油污的原因:CO
+2H2O
H2CO3+2OH-
C. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-===SiO
+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+===Cl2↑+H2O
难度: 简单查看答案及解析
-
右图为元素周期表中短周期的一部分,4种元素中只有一种是金属,下列说法不正确的是( )
A. 四种元素中Z一定为金属
B. 原子半径:Z>W
C. W的氧化物对应水化物一定是强酸
D. X的氢化物有可能是平面型分子
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 淀粉和纤维素都可以在酸性条件下水解生成葡萄糖
B. 煤的气化、液化和干馏都是煤综合利用的主要方法,都属于物理变化
C. 地沟油发生皂化反应后加入饱和食盐水,搅拌发现液面上有固体物质
D. 蛋白质溶液中加入浓的硫酸铵溶液,有固体析出
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法正确的是( )
A. 常温常压下,28 g CO和N2的混合物含有的分子数为 NA
B. 标准状况下,1 mol氦气中含有的核外电子数为4NA
C. 标准状况下,22.4 L 苯中含有的苯分子数是NA
D. 常温常压下,0.10 mol·L-1CH3COOH溶液中含有的H+数小于0.1NA
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法正确的是( )
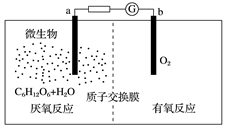
A. b极为正极,发生氧化反应
B. 外电路中电子的移动方向为b→a
C. 质子通过交换膜从b极区移向a极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
难度: 中等查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1 mol·L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1 mol·L-1HNO2溶液稀释至100倍,pH约为3.1
A. ①④⑥ B. ①②③④
C. ①④⑤⑥ D. 全部
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是( )
A. Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量
B. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2
C. 101 kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,则H2的标准燃烧热为-571.6 kJ·mol-1
D. H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol的氢氧化钠固体与含0.5 mol H2SO4的溶液混合后放出57.3 kJ的热量
难度: 中等查看答案及解析
-
下列每组物质发生变化所克服的粒子间的作用力属于同种类型的是( )
A. 氯化铵受热气化和苯的气化
B. 碘和干冰受热升华
C. 二氧化硅和生石灰的熔化
D. 氯化钠和铁的熔化
难度: 中等查看答案及解析
-
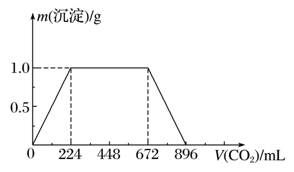
在50 mL过氧化氢溶液中加入1 g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
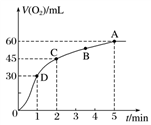
A. 标准状况下,实验放出一半气体所需的时间为1 min
B. A、B、C、 D各点反应速率中A点最慢,D点快
C. 0~2 min内产生O2的平均反应速率为22.5 mL·min-1
D. 本实验中影响反应速率的因素只有催化剂和H2O2的浓度
难度: 中等查看答案及解析
-
在常温下,用0.100 0 mol·L-1的盐酸滴定25 mL 0.100 0 mol·L-1 Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
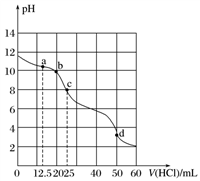
A. a点:c(HCO
)>c(Cl-)>c(CO
)
B. b点:c(Na+)+c(H+)=c(Cl-)+c(HCO
)+c(CO
)+c(OH-)
C. c点:c(OH-)+c(CO
)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
难度: 困难查看答案及解析
-
已知酸性: H2CO3>HClO>HCO
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列离子方程式正确的是( )
A. Fe3+与I-不能共存的原因:Fe3++2I-===Fe2++I2
B. 向NaClO溶液中滴加浓盐酸:ClO-+ H+===HClO
C. 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+ H2O===HClO+CO
D. 向含1 mol FeBr2溶液中通入1 mol Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
难度: 困难查看答案及解析
-
某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子
K+、NH
、Fe2+、Mg2+、Cu2+
阴离子
OH-、Cl-、CO
、SO
某同学进行了如下实验(必要时可加热):
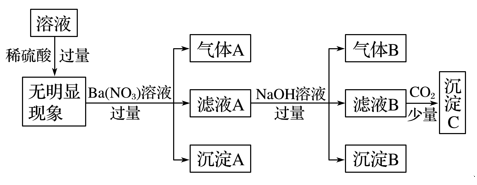
下列说法正确的是( )
A. 由沉淀A推断原溶液中一定含有SO
B. 原溶液中只含有NH
、Fe2+、Cl-、SO
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
难度: 困难查看答案及解析
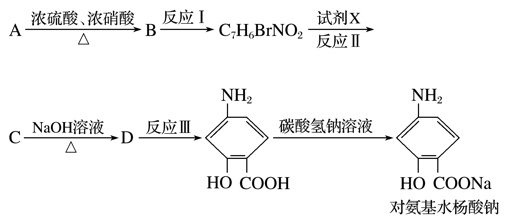
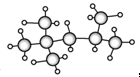 ,其分子式为________________,A的一氯代物有________种;A有多种同分异构体,写出其中一氯代物只有一种的同分异构体的结构简式____________________。
,其分子式为________________,A的一氯代物有________种;A有多种同分异构体,写出其中一氯代物只有一种的同分异构体的结构简式____________________。
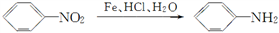 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)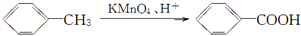
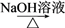 R—OH
R—OH