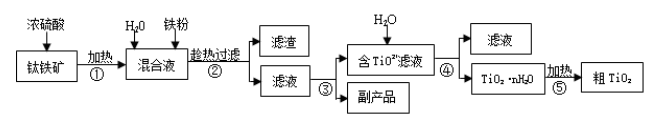
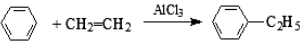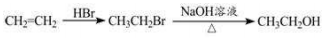-
ClO2是一种国际公认的高效含氯消毒剂,ClO2属于
A. 混合物 B. 酸 C. 碱 D. 氧化物
难度: 简单查看答案及解析
-
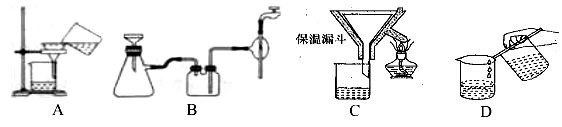
下列仪器名称书写正确的是
A.
 B.
B.  C.
C. 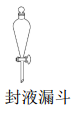 D.
D. 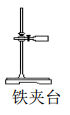
难度: 简单查看答案及解析
-
下列电离方程式书写不正确的是
A. CaCl2=Ca2++2Cl- B. NH3·H2O===NH4++OH-
C. CH3COOH=CH3COO-+H+ D. H2SO4=2H++SO42-
难度: 中等查看答案及解析
-
2Na+ 2H2O=2NaOH+ H2↑的反应类型是
A. 置换反应 B. 化合反应 C. 分解反应 D. 复分解反应
难度: 简单查看答案及解析
-
下列物质的水溶液因水解而显酸性的是
A. CH3COOH B. NaHSO4 C. NH4Cl D. Na2CO3
难度: 中等查看答案及解析
-
下列有关物质的用途不正确的是
A. 高纯度的单质硅可用于制作计算机芯片 B. 钠钾合金可在快中子反应堆中作热交换剂
C. 二氧化硫不可用作熏蒸粉丝 D. 碳酸钠可用于治疗胃酸过多
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A. NaCl的电子式为:
B. 水分子的比例模型:
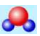
C. 乙烯的结构简式:CH2CH2 D. 硫离子结构示意图:
难度: 简单查看答案及解析
-
要除去 FeCl2 溶液中的少量 FeCl3,可行的是
A. 加入铜粉 B. 滴入 KSCN 溶液 C. 加入铁粉 D. 通入氯气
难度: 中等查看答案及解析
-
下列物质属于电解质的是
A. 液氨 B. 石墨 C. 酒精 D. 氯化氢
难度: 简单查看答案及解析
-
下列实验方法或操作正确的是
A.
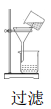 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 向鸡蛋清的溶液中加入饱和硫酸钠溶液,鸡蛋清因发生变性而沉淀析出
B. 溶液和胶体的鉴别可利用丁达尔效应
C. 进行焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
D. 水晶和陶瓷的主要成分都是硅酸盐
难度: 中等查看答案及解析
-
下列物质的分离提纯方法选择不正确的是
A
除去氯化钠溶液中的泥沙
过滤
B
用四氯化碳提取溴水中的溴
萃取
C
分离乙酸(沸点 118℃ )与乙酸乙酯(沸点 77℃ )
分液
D
从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
结晶
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中,有可逆反应: 2NO(g)+O2(g)
2NO2(g) △H﹤0,其中NO为无色气体,NO2为红棕色气体。下列不能说明反应已达到平衡状态的是
A. v(NO2) = v(O2) B. 反应器中的压强不随时间变化而变化
C. 混合气体的颜色保持不变 D. 混合气体的平均相对分子质量保持不变
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 铁和盐酸溶液反应:2Fe + 6H+ === 2Fe3+ +3 H2↑
B. 氯气和水反应:Cl2 + H2O
2 H+ + Cl- + ClO
C. 氢氧化钡溶液与硫酸铜溶液反应:Ba2+ + SO42- = BaSO4↓
D. 氯化铁溶液与氨水溶液反应: Fe3+ + 3 NH3·H2O === Fe (OH)3 ↓+ 3NH4+
难度: 中等查看答案及解析
-
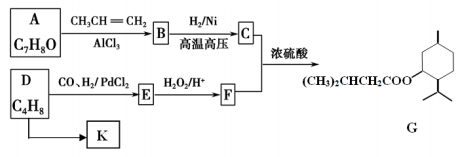
下列有关有机物结构、性质的分析正确的是
A. 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同
B. 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键
C. 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化
D. 乙醇在铜催化作用下,能发生还原反应生成乙醛
难度: 中等查看答案及解析
-
已知 X、Y、Z、R、W均为短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15; X与 Z可形成XZ2分子, Y与 R形成的气态化合物在标准状况下的密度为 0.76g·L-1,W是短周期中金属性最强的元素。下列说法正确的是
A. W与Z只能形成阴、阳离子数之比为 1:2 的化合物
B. 原子半径大小顺序: W﹥Z﹥Y﹥X
C. X 能形成多种单质,且均为原子晶体
D. X、Y、Z均能形成最高价氧化物的水化物,且酸性逐渐增强
难度: 困难查看答案及解析
-
下列说法正确的是
A. 氢氧化钠是离子化合物,该物质中只存在离子键
B. 干冰在升华的过程中,只需要克服分子间作用力
C. 12 C与 13 C由于核外电子排布不同,所以属于同位素
D. 在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质
难度: 中等查看答案及解析
-
下列有关原电池的叙述中不正确的是
A. 原电池是将化学能转化为电能的装置
B. 在原电池中,电子流出的一极是负极,发生氧化反应
C. 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动
D. 构成原电池的两个电极必须是活泼性不同的两种金属
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 石油的裂化、裂解和煤的气化、液化都是化学变化
B. 生物质能来源于植物及其加工产品所贮存的能量,是可再生能源
C. 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D. 糖类、油脂和蛋白质都为高分子化合物,在一定条件下均可水解
难度: 中等查看答案及解析
-
化学反应 A2(g) +B2(g)=2AB(g) ΔH,其能量变化如图所示,下列叙述正确的是
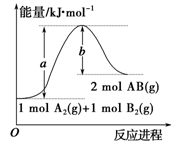
A. 断裂 1 mol A2 和 1 mol B2 中的化学键,放出a kJ 能量
B. ΔH=+(a-b)kJ·mol-1
C. 每生成 2 个AB分子吸收 b kJ 热量
D. 该反应中反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数的值。下列判断正确的是
A. 44g CO2 含有的原子数目为 NA
B. 1L1 mol·Lˉ1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA
C. 足量的 MnO2 与 100ml12 mol·L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA
D. 常温常压下,18mL 水含有的分子数目约为 NA
难度: 中等查看答案及解析
-
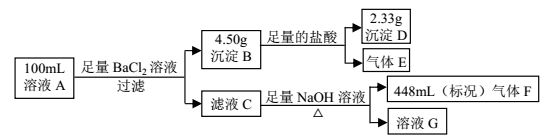
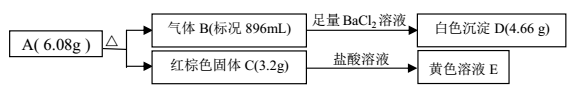
某工厂用 FeCl3 溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL 废液加入足量的 AgNO3 溶液,生成沉淀 8.61g。(2)另取 10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A. 一定含有 Fe 2+、 Fe 3+、 Cu2+、 Clˉ B. c(Fe2+):c(Cu2+) = 2:1
C. c(Clˉ) = 6mol / L, c(Fe 2+) = 1.2mol / L D. c (Fe2+):c(Fe 3+) = 3:1
难度: 困难查看答案及解析
-
现有下列三个氧化还原反应:
① 2B- + Z2 = B2+2 Z - ② 2A2+ + B2 = 2A3+ + 2B- ③ 2XO4- + 10Z - + 16H+ = 2X2+ + 5Z2 + 8H2O
根据上述反应,判断下列结论中错误的是
A. 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2
B. 还原性强弱顺序为: A2+﹥B-﹥Z-﹥X2+
C. X2+是 XO4- 的还原产物, B2 是 B-的氧化产物
D. 在溶液中可能发生反应: XO4- +5 A2++ 8H+ = X2+ + 5A3+ + 4H2O
难度: 困难查看答案及解析
-
在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是
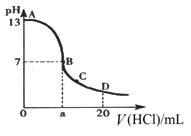
A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
难度: 困难查看答案及解析