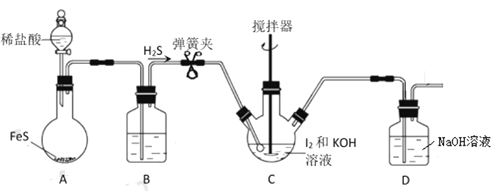
-
下列对于各种物质的应用说法错误的是
A. 硅胶作袋装食品的吸氧剂
B. 二氧化硫作纸浆的漂白剂
C. Al(OH)3可添加到塑料中作阻燃剂
D. ClO2是一种比Cl2更安全的自来水消毒剂
难度: 中等查看答案及解析
-
有机物X、Y、Z的分子式均为C7H8,结构简式如下:
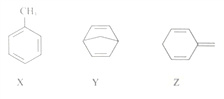
下列说法正确的是
A. X、Y、Z均为苯的同系物
B. X、Y、Z分子中的碳原子均处于同一平面
C. X、Y、Z均能使酸性高锰酸钾溶液褪色
D. 1molX、1molY分别与足量溴的四氯化碳溶液反应,均最多消耗2mol Br2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1molN5+N5-(全氮类物质)中含有电子总数为5NA
B. 在浓硫酸存在下加热,1molCH3CH2OH和1mol CH3COOH充分反应生成的H2O分子数为NA
C. 在光照条件下,0.1molCH4与0.1molCl2反应恰好生成CH3Cl的分子数为0.1NA
D. 在反应Mg +2NH4Cl===MgCl2+2NH3↑+H2↑中,1.2gMg完全反应时转移的电子数为0.1NA
难度: 中等查看答案及解析
-
V、W、X、Y、Z是前四周期主族元素,它们的原子序数依次增大,其中X和Z是金属元素。V和Z属同一主族,它们原子最外电子层上只有1个电子,W和Y也属同一族,W原子最外电子层上电子数是次外电子层上电子数的3倍,X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半。下列说法不正确的是
A. X、Y、Z的简单离子中,Y的离子半径最大
B. 在Z2Y2W3溶液中加入稀硫酸会析出黄色沉淀
C. V、Z分别与W形成的二元化合物中,可能含有非极性共价键
D. 在常温下,X、Z的单质均能与水剧烈反应
难度: 中等查看答案及解析
-
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用Pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。下列说法不正确的是
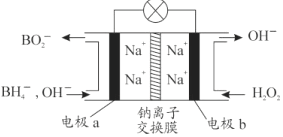
A. 每消耗3mol H2O2,转移6mol e﹣
B. 电池工作时Na+从b极区移向a极区
C. a极上的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D. b极材料是MnO2,该电池总反应方程式:NaBH4 + 4H2O2===NaBO2 + 6H2O
难度: 中等查看答案及解析
-
由下列实验及现象得出的结论,不正确的是
实验
现象
结论
A
向KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
B
在Cu(NO3)2溶液中加入KI溶液,再加入苯,振荡
溶液分层,上层溶液呈紫色,下层有白色沉淀
氧化性:Cu2+>I2,白色沉淀可能为CuI
C
向2 支盛有2mL 相同浓度的NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置
前者无沉淀,后者有白色沉淀
Ksp[Al(OH)3]>Ksp[Mg(OH)2]
D
相同温度下,在两支试管中各加入4 mL 0.01 mol/L KMnO4酸性溶液和2 mL 0.1 mol/LH2C2O4溶液,再向其中一支试管中快速加入少量MnSO4固体
加有MnSO4的试管中溶液褪色明显较快
MnSO4对该反应有催化作用
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与
变化的关系如图所示。下列叙述正确的是
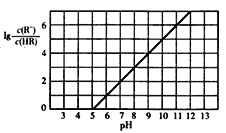
A. 由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10
B. 当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+)
C. pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+)
D. pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O)
难度: 困难查看答案及解析


 的合成路线(无机试剂任选)______________________________________。
的合成路线(无机试剂任选)______________________________________。