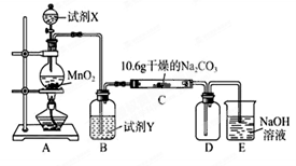
-
常温下, 下列各组物质中,Y既能与X反应又能与Z反应的是( )
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
稀盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A. ①③ B. ①④ C. ②④ D. ②③
难度: 中等查看答案及解析
-
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的稳定性为H2T<H2R
B. 单质与稀盐酸反应的剧烈程度为L<Q
C. R最高价氧化物对应水化物是强酸
D. L2+与R2-的核外电子数相等
难度: 困难查看答案及解析
-
下列说法正确的
A.海带中碘的提取实验中,将海带灰溶于水,过滤后在滤液中加入CCl4即可萃取
B.减压过滤可以过滤胶状沉淀或颗粒太小的沉淀
C.可通过观察硫代硫酸钠溶液和硫酸反应产生气体的快慢来比较化学反应速率的快慢
D.在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.阿伏加德罗常数的准确值应为6.02×1023mol-1
B.标准状况下,17g氨气的体积为22.4L/mol
C.常温常压条件下,3.6gH2O所含氢原子数为0.4NA
D.浓度为0.1 mol/LNa2CO3溶液中,Na+数为0.1NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.糖类、油脂和蛋白质都是高分子化合物
B.蛋白质的盐析和变性都是化学变化
C.石油的分镏和煤的干镏都是物理变化
D.乙醇和乙酸都能与金属钠发生反应
难度: 简单查看答案及解析
-
将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)
2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是 ( )
A.平均相对分子质量 B.SO3(g)的转化率
C.c(SO3)/c(SO2) D.c2(SO3)/[c2(SO2)·c(O2)]
难度: 简单查看答案及解析
-
下列溶液中不存在氯离子的是( )
A.氯水 B.氯化氢
溶液 C.氯酸钾溶液 D.“84”消毒液液
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A.常温常压下,16 g 由O2和O3组成的混合气体所含电子数为8NA
B.实验室分别用KClO3和H2O2制取3.2g O2时,转移的的电子数均为0.4NA
C.25℃时,1 L pH=1的稀硫酸中约含2NA个H+
D.标准状况下,22.4 L SO3所含分子数为NA
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙酸乙醋中少量的乙酸:用饱和碳酸钠溶液洗涤、分液
③除去CO2中少量的SO2:气体通过盛有饱和碳酸氢钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰,蒸镏
A. ①② B. ③④ C. ②③④ D. ②③
难度: 中等查看答案及解析
-
利用相似相溶原理不能解释的是( )
A、I2微溶于水,易溶于CCl4;HCl易溶于水
B、在水中的溶解度:C2H5OH>CH3CH2CH2CH2CH2OH
C、不同的烃之间相互溶解
D、I2易溶于KI溶液中
难度: 中等查看答案及解析
-
下列各组物质相互反应时,水作氧化剂的是
①Na和H2O ②Na2O和H2O ③Fe和H2O(g) ④Na2O2和H2O
A.①③ B.①④ C.②③ D.②④
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 过氧化钠与反应:2O22-+2H2O=4OH-+O2↑
C. 碳酸氢钠与稀盐酸反应:CO32-+2H+=CO2↑+ H2O
D. 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
难度: 中等查看答案及解析
-
中国著名药学家屠呦呦因制成了青蒿素而获得2015年度诺贝尔生理 学或医学奖。青蒿素的结构如右图,关于该物质的分类正确的是
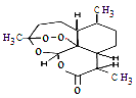
A.单质 B.有机物
C.无机物 D.有机高分子化合物
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.HCl的电子式为H+
B.S2-的结构示意图为
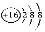
C.O-16原子的符号为
D.
、
、
含有相同的中子数
难度: 中等查看答案及解析
-
实验室中,从海藻里提取碘的部分流程如下图。下列说法中,不正确的是
A.试剂a可选用酸化的双氧水
B.试剂b可选用酒精
C.步骤③的操作是过滤
D.步骤①需用坩埚,步骤⑤需用分液漏斗
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 L氧气中所含有的原子数为NA
B.7.8g的Na2O2中含有的阴离子的数目为0.2NA
C.0.10 mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10 NA
D.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA
难度: 中等查看答案及解析
-
向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1 mL 0.2 mol/L氨水,观察到有白色沉淀生成,再滴加1 mL 0.1 mol/L FeCl3溶液,发现白色沉淀转化为红褐色沉淀。由以上现象可以推知,下列叙述正确的是
A. 生成白色沉淀的离子方程式是:Mg2++2OH-=Mg(OH)2↓
B. 白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+==3Mg2++2Fe(OH)3
C. 上述实验说明Mg(OH)2的Ksp小于Fe(OH)3的Ksp
D. 最后所得的溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(Mg2+)>c(Fe3+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是
选项
容量瓶容积
溶质质量
实验操作
A
480mL
硫酸铜:7.68g
加入 500mL水
B
480mL
胆矾:12.0g
配成500mL溶液
C
500mL
硫酸铜:8.0g
加入500mL水
D
500mL
胆矾:12.5g
配成500mL溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量物质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Al
Na2SO4溶液
Y
FeCl3
CuCl2
Fe
Na2CO3
Z
Fe
Fe
NaOH溶液
BaCl2溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,A和X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,下列有关说法正确的是( )
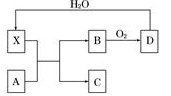
A.X能使蔗糖变黑主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最终一定有白色沉淀产生
D.工业上,B转化为D的反应需使用催化剂
难度: 困难查看答案及解析