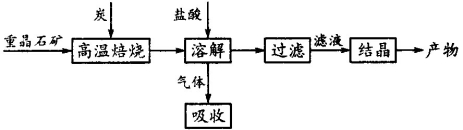
-
下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B.硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
难度: 中等查看答案及解析
-
用pH试纸测定某溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色 卡对照,溶液的pH测得值为8,则该溶液的实际pH( )
A.大于8 B.小于8 C.等于8 D.小于7
难度: 简单查看答案及解析
-
将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(OH-)和c(H+)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
难度: 简单查看答案及解析
-
下列事实能说明HNO2为弱电解质的是( )
①0.1 mol/L HNO2溶液的pH=2.1
②常温下NaNO2溶液的pH>7
③用HNO2溶液做导电实验时,灯泡很暗
④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2
⑥HNO2不稳定,易分解
A.①②③ B.①②④⑤ C.①②⑥ D.①②
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
难度: 中等查看答案及解析
-
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO
、Cl-、K+
C.pH=1的溶液中:NH
、Cl-、Cu2+、SO
D.无色溶液中:Al3+、HCO
、、I-、K+
难度: 简单查看答案及解析
-
常温下a mol/L稀氨水和b mol/L稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
A.若a<b,则c(OH-)<c(H+) B.若a=b,则c(NH4+)=c(Cl―)
C.若a>b,则c(NH4+)>c(Cl―) D.若a>b,则c(OH-)>c(H+)
难度: 简单查看答案及解析
-
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05mol
/L的Ba(OH)2溶液,③pH=5的NH4NO3溶液,④pH=10的Na2S溶液中,发生电离的水的物质的量之比是( )
A.1:10:109:104 B.1:5:5×109:5×108 C.1:20:109:1010 D.1:10:109:1010
难度: 中等查看答案及解析
-
下列化学(或离子)方程式不正确的是( )
A.NaHS溶液存在电离平衡:HS-+H2O
S2-+H3O+
B.用碳酸钠溶液浸泡锅炉水垢:CO32-+CaSO4===CaCO3+SO42-
C.Ca(OH)2在水溶液中电离:Ca(OH)2===Ca2++2OH-
D.将明矾放入浑浊的河水中,可使水澄清:Al3++3H2O===Al(OH)3↓+3H+
难度: 中等查看答案及解析
-
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点(两曲线交点)时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
难度: 简单查看答案及解析
-
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强
碱与强酸的体积比是( ).
A.11∶1 B.9∶1 C.1∶11 D.1∶9
难度: 简单查看答案及解析
-
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水; ④pH=12的NaOH溶液。下列说法正确的是( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将①④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
C.将四份溶液分别稀释到原体积相同倍数后,溶液的pH:③>④,②>①
D.将②③混合,若pH=7,则消耗溶液的体积:②>③
难度: 简单查看答案及解析
-
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图19,下列说法正确的是( )
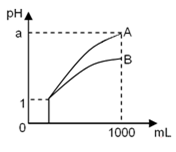
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11mol·L-1
难度: 中等查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )。
A.水的电离程度始终增大
B.
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH
)=c(CH3COO-)
难度: 简单查看答案及解析
-
25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
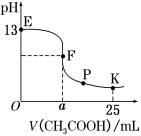
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
难度: 简单查看答案及解析
-
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
酸
HX
HY
HZ
浓度(mol/L)
0.1
0.5
1
1
1
pH值
3.53
3.12
3.05
2.52
1
电离常数
Ki1
Ki2
Ki3
Ki4
Ki5
A.Ki1>Ki2>Ki3 B.Ki5>Ki4>Ki3
C.NaZ溶液中c(H+) = c(OH-) D.HX + Y- === HY + X-
难度: 中等查看答案及解析
-
液氨和水类似,也能电离:NH3+NH3
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
A.c(Na+) = c(NH2-) B.c (NH4+) = 1×10-29mol/L
C.c(NH2-) > c (NH4+) D.c(NH4+)∙c(NH2-) = l.0×l0-30
难度: 中等查看答案及解析
-
已知水的电离平衡曲线如图所示,下列说法正确的是( )
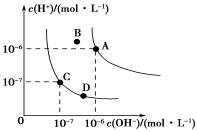
A.水的离子积常数
关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可以从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混
合,溶液的pH=7
D.升高温度可实现由C点到D点
难度: 简单查看答案及解析
-
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )。
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若
分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序③>①>②
难度: 简单查看答案及解析
-
下图表示的是难溶氢氧化物在不同pH下的溶解度(S,mol/L),下列说法中正确的是( )
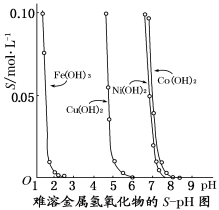
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
难度: 简单查看答案及解析