-
下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应都不需要加热就能发生
C.吸热反应在一定条件(如常温、加热等)也能发生
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量的大小
难度: 简单查看答案及解析
-
下列反应没有涉及原电池的是( )
A.生铁投入稀盐酸中 B.铜片与银片用导线连接后,同时插入FeCl3溶液中
C.纯锌投入硫酸铜溶液中 D.含铜的铝片投入浓硫酸中
难度: 简单查看答案及解析
-
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
难度: 简单查看答案及解析
-
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
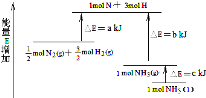
A.N2(g)+3H2(g)=2NH3(l);△H=2(a﹣b﹣c)kJ•mol﹣1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b﹣a)kJ•mol﹣1
C.
N2(g)+
H2(g)=NH3(l);△H=(b+c﹣a)kJ•mol﹣1
D.
N2(g)+
H2(g)=NH3(g);△H=(a+b)kJ•mol﹣1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.电池充电时其正极应与外电源的负极相连而成为阴极
B.氢氧燃料电池(碱性介质)的正极反应 式:O2+4e﹣→2O2﹣
C.粗铜精炼时,与电源正极相连的是纯铜
D.铁件上镀铜时,将铁件与电源的负极相连
难度: 简单查看答案及解析
-
如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是( )

A.装置出口①处的物质是氯气
B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C.装置中发生的反应的离子方程式2Cl﹣+2H+
Cl2↑+H2↑
D.该装置是将电能转化为化学能
难度: 困难查看答案及解析
-
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )
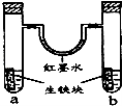
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中负极电极反应相同
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色.则下列说法错误的是( )
A.a电极是阴极 B.b电极与电源的正极相连接
C.电解过程中,水是氧化剂 D.a电极附近溶液的pH变小
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.CO(g)的燃烧热是283.0kJ/mol ,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
B.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.钢铁腐蚀的正极反应:Fe﹣3e﹣=Fe3+
B.铁船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.原电池是将化学能转化为电能的装置
D.工业上电解饱和食盐水的阳极反应:2Cl﹣﹣2e﹣=Cl2↑
难度: 中等查看答案及解析
-
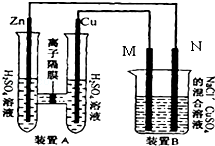
关于如图所示装置的判断,叙述正确的是( )
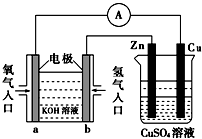
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
难度: 中等查看答案及解析
-
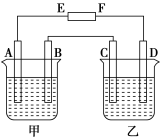
甲、乙两个电解池均为Pt为电极,且互相串联.甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液.通电一段时间后,测得甲池电极质量增加2.16g,乙池电极上析出0.24 g金属,则乙池中的溶质可能是( )
A.MgSO4 B.Al(NO3)3 C.CuSO4 D.Na2SO4
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
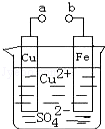
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成 浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
已知298K时,合成氨反应N2(g)+3H2(g)
2NH3(g)△H=﹣92.0kJ•mol﹣1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失)( )
A.一定大于92.0 kJ B.无法确定
C.一定等于92.0 D.一定小于92.0 kJ
难度: 简单查看答案及解析
-
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯
A. ①③⑥ B. ②③⑤ C. ①②③⑥ D. 全部
难度: 简单查看答案及解析
-
下列关于化学电源的说法不正确的是( )
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极
难度: 中等查看答案及解析
-
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
难度: 中等查看答案及解析
-
在H2O中加入等物质的量的Ag+、Na+、Ba2+、NO3﹣、SO42﹣、Cl﹣,该溶液在惰性电极的电解槽中通电片刻后,氧化产物和还原产物的质量比是( )
A.1:2 B.8:1 C.35.5:108 D.108:35.5
难度: 简单查看答案及解析
-
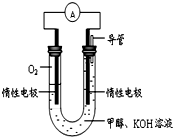
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol﹣1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ•mol﹣1
下列说法正确的是( )
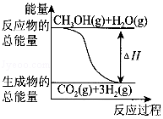
A.CH3OH的燃烧热(△H)为﹣192.9kJ•mol﹣1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)
=CO2(g)+2H2(g)的△H>﹣192.9kJ•mol﹣1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.若2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1,则H2燃烧热(△H)为﹣241.8kJ•mol﹣1
B.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
D.由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol﹣1①
BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol﹣1②可得反应
C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ•mol﹣1
难度: 简单查看答案及解析
-
铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH) 2下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH﹣﹣2e﹣═Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣═Ni2O3+3H2O
难度: 简单查看答案及解析
-
用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
难度: 简单查看答案及解析
-
下图有关电化学的示意图正确的是( )
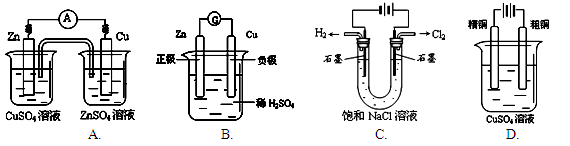
难度: 简单查看答案及解析
-
用惰性电极分别电解下列各电解质的水溶液,一段时间后(设电解质足量),向电解后溶液中加入适量原电解质,可以使溶液恢复到电解前的浓度的是( )
A.Cu(NO3)2 B.K2SO4 C.HCl D.NaOH
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuS04溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系如图所示,其中正确的是( )
A.
B.
C.
D.
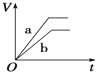
难度: 简单查看答案及解析
-
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
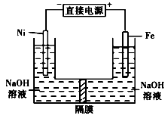
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42 -+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe 电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置.电极I为Al,其他电极均为Cu,则( )
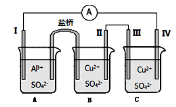
A.工作一段时间后,C烧杯的PH减小
B.电极I发生还原反应
C.盐桥中的K+移向A烧杯
D.电流方向:电极Ⅳ→
→电极I
难度: 简单查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.﹣1780kJ/mol B.﹣1220 kJ/mol C.﹣450 kJ/mol D.+430 kJ/mol
难度: 简单查看答案及解析
-
如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )
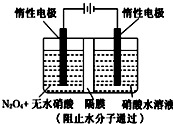
A.阴极的电极反应为:NO3﹣+4H++3e﹣=NO↑+2H2O
B.阳极的电极反应为:N2O4+2 HNO3﹣2e﹣ =2N2O5+2H+
C.当电路中通过6 mol e﹣时整个电解池中参与反应的HNO3为8mol
D.当电路中通过6 mol e﹣时,有8molH+从阳极向阴 极迁移
难度: 简单查看答案及解析
-
用石墨电极电解CuSO4和KNO3的混合溶液500mL,经一段时间电解后,两极都得到11.2L气体(标准状况下体积),则此混合液中硫酸铜的物质的量浓度为 ( )
A.0.5 mol / L B.0.8 mol / L C.1 mol / L D.1.5 mol / L
难度: 简单查看答案及解析
-
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=﹣632kJ•mol﹣1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
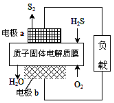
A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+2H2O+4e﹣=4 OH﹣
C.电路中每流过4mol电子,电池内部释放632kJ热能
D.每17gH2S参与反应,有1mol H+经质子膜进入正极区
难度: 简单查看答案及解析