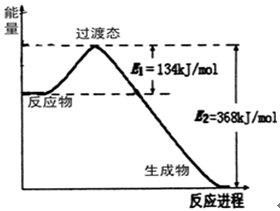
-
下列有关能源与能量的说法正确的是
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量的相对大小决定反应是放热还是吸热
难度: 中等查看答案及解析
-
下列表示物质或微粒的化学用语正确的是
A.氮分子的结构式:N—N
B.Mg2+的结构示意图:
C.二氧化碳电子式:
D.钙离子的电子式:Ca2+
难度: 中等查看答案及解析
-
23592U和23892U是铀的两种主要的同位素。U是制造原子弹和核反应堆的主要原料。下列有关说法正确的是
A.U原子核中含有92个中子
B.U原子核外有143个电子
C.23592U和23892U互为同位素
D.23592U和23892U互为同素异形体
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
下列实验中不能出现沉淀现象的是
A.NO2和SO2气体同时通入BaCl2溶液中
B.SO2气体通入BaCl2溶液中
C.SO2气体通入Ba(NO3)2溶液中
D.SO2气体和过量NH3同时通入BaCl2溶液中
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
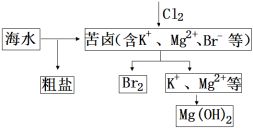
A.向苦卤中通入Cl2是为了提取溴
B.获取金属Mg可采用电解MgCl2溶液的方法
C.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
D.粗盐可采用除杂和重结晶等过程提纯
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)===C(金刚石,s) ΔH >0,则金刚石比石墨稳定
C.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1, 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol。有关键能数据如下表:
化学键
H—H
O=O
键能/KJ▪mol-1
436
498
则水分子中O—H键键能为
A.463.4KJ/mol B.926.8KJ/mol
C.221.6KJ/mol D.413KJ/mol
难度: 中等查看答案及解析
-
下述实验操作与预期实验目的或所得实验结论不一致的是
编号
实验操作
实验目的或结论
A
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色
证明SO2有漂白性
B
向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化
探究增大反应物浓度时平衡移动的方向
C
将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化
探究温度对化学平衡的影响
D
将CO2通入Na2SiO3水溶液观察是否有沉淀产生
探究碳和硅两元素非金属性强弱
难度: 中等查看答案及解析
-
下列叙述中一定能判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A.v(O2)=0.01mol/(L·s) B.v(NO)=0.08mol/(L·s)
C.v(H2O)=0.003mol/(L·s) D.v(NH3)=0.001mol/(L·s)
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应 A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
A.①②③ B.②③⑤ C.①③⑤ D.①④⑤
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法正确的是
/L积体气温体c(Y)/mol•L-1度/℃
1
2
3
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
 A.m > n
A.m > nB.Q < 0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
已知:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
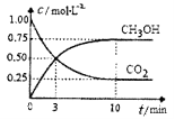
A.升高温度平衡常数K增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1
难度: 中等查看答案及解析
-
已知H2、CH4的燃烧热分别为286KJ/mol、890KJ/mol。实验测得氢气和甲烷的混和气体共1mol完全燃烧时放热588kJ,则混和气体中氢气与甲烷的体积比约为
A.3:1 B.2:1 C.1:1 D.1:2
难度: 中等查看答案及解析
-
(普通班做)现有反应:CO(g)+ H2O(g)
CO2 (g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
(1)当CO转化率为25%时,该反应是否达平衡,向哪个方向进行?
(2)达平衡时,CO转化率为多少?
(3)平衡时,H2的体积分数为多少?
(4)平衡时,混合气体的平均相对分子质量为多少?
难度: 中等查看答案及解析