-
下列实验操作中错误的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出
D.萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶
难度: 简单查看答案及解析
-
化学实验应与化工生产一样遵循绿色化学的原则,实现原料和过程绿色化。下列操作符合绿色化学原则的是
A.为便于观察铜在氯气中燃烧的现象,加大氯气的使用量
B.实验室改用H2O2和MnO2反应,代替加热KClO3和MnO2制取氧气
C.焚烧塑料、橡胶等废弃物是处理城市生产、生活垃圾的有效方法
D.制取CuSO4: Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
难度: 中等查看答案及解析
-
为除去括号内的杂质,所选用的试剂或方法不正确的是
A.NaHCO3溶液(Na2CO3溶液) 通入过量的CO2
B.铁粉(铝粉) 加入适量的NaOH溶液过滤
C.Na2CO3溶液(Na2SO4溶液) 加入适量的Ba(OH)2溶液过滤
D.CO2 (CO) 将混合气体通过足量灼热的CuO
难度: 中等查看答案及解析
-
下列有关化学用语表述正确的是
A.CO2的电子式
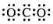 B.Cl-的结构示意图
B.Cl-的结构示意图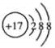
C.次氯酸的结构式 H-Cl-O D.质量数为37的氯原子 17 37Cl
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.1mol乙烷(CH3CH3)中含有共价键的数目为6NA
B.由CO2和O2组成的混合气体共有NA个分子,其中氧原子数为2NA
C.标准状况下,22.4LH2O中含氢原子数为2NA
D.制取84消毒液(NaClO),消耗0.5mol氯气转移电子数为NA
难度: 中等查看答案及解析
-
Cu—Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极 ④溶液中SO42-移向铜极
A.①④ B. ③④ C. ②③ D.①③
难度: 中等查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到反应限度的标志是
A.容器内气体的总压强不随时间变化而变化
B.A2和B2物质的量之和与AB的物质的量相等
C.c(A2):c(B2):c(AB)=1:1:2
D.A2、B2和AB的物质的量不再改变
难度: 中等查看答案及解析
-
2014年4月10日,兰州发生自来水苯含量超标事件。苯是石油化工的基本原料,苯进入人体内,可在造血组织本身形成有血液毒性的代谢产物,被世界卫生组织认定为致癌物质。下列关于苯的叙述正确的是
A.苯环是单、双键交替组成的平面环状结构
B.苯和乙烯均能使酸性KMnO4溶液褪色
C.苯的硝化反应:属于取代反应
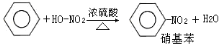
D.苯跟溴水在催化剂作用下发生取代反应生成溴苯
难度: 中等查看答案及解析
-
下列叙述错误的是
A.乙醇(CH3CH2OH)和二甲醚(CH3OCH3)互为同分异构体
B.CH2=CH-CH2-CH3和CH2=CH-CH=CH-CH2-CH3属于同系物
C.石墨与C60是同素异形体
D.1H、2H、3H是氢的三种同位素
难度: 中等查看答案及解析
-
人剧烈运动,会因骨骼肌组织供氧不足,导致葡萄糖无氧氧化,产生大量酸性物质
,该物质大量堆积于腿部会引起肌肉酸痛。该物质体现酸性的官能团是
A.甲基 B.羰基 C.羧基 D.羟基
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,在周期表中的位置如下图所示,下列叙述正确的是
Z
Y
X
A.X一定是活泼金属
B.Y的最高价氧化物是酸性氧化物
C.Z的单质是双原子分子
D.氢化物的稳定性:Y>X
难度: 中等查看答案及解析
-
有关化学键和化合物的叙述不正确的是
A.盐酸中含有H+和Cl-,所以HCl是离子化合物
B.Na2O2中含有离子键和非极性共价键
C.完全由非金属元素组成的化合物可能是离子化合物
D.双原子或多原子的单质分子中均存在化学键
难度: 中等查看答案及解析
-
对于放热反应:H2+Cl2
2HCl,下列说法错误的是
A.反应物的总能量大于生成物的总能量
B.该反应遵循“能量守恒定律”
C.该反应中,化学能只转变成热能
D.断开1molH-H键和1molCl-Cl键所吸收的总能量小于形成2molH-Cl键所放出的能量
难度: 中等查看答案及解析
-
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是
A.NH4+、K+、Cl-、OH- B.H+、Fe2+、MnO4-、Cl-
C.Ba2+、Na+、NO3-、SO42- D.Na+、H+、CO32-、SO42-
难度: 中等查看答案及解析
-
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、
Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
难度: 中等查看答案及解析
-
现有X、Y两种VA族元素,下列事实不能说明X的非金属性比Y强的是
A.两种元素所形成的气态氢化物的稳定性:XH3>YH3
B.两种元素所形成的酸的酸性:H3XO4>H3YO4
C.两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5
D.两种元素形成气态氢化物的难易程度:X易于Y
难度: 中等查看答案及解析
-
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度
A.①② B.③④ C.①②③④ D.①②③
难度: 中等查看答案及解析
-
下列离子方程式对应的化学方程式正确的是
A.H++OH-=H2O CH3COOH+NaOH=CH3COONa+H2O
B.Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.CO32-+2H+=CO2↑+H2O CaCO3+2HCl=CaCl2+CO2↑+H2O
D.3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
难度: 中等查看答案及解析