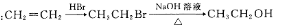-
物质应用与其性质密切相关。下列说法错误的是
A.硅胶可防止食物受潮是由于其具有吸水性
B.葡萄糖用于医疗输液是因为它属于强电解质
C.Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性
D.酸性重铬酸钾用于检查酒驾是利用其强氧化性
难度: 简单查看答案及解析
-
分子式为C4H10O的有机物含有-CH2OH基团的同分异构体有
A.2种 B 3种 C.4种 D.5种
难度: 简单查看答案及解析
-
已知A、B、C、I)是短周期中原子序数依次增大的四种主族元素。A:在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
A. A、C的氧化物均含离子键
B. c离子的半径小于D离子的半径
C. A、B可形成多种原子个数比为1:1的化合物D含D元素的盐溶液只能显碱性
难度: 简单查看答案及解析
-
乙烯和丙烯属于同系物。下列叙述正确的是
A.等质量的乙烯和丙烯完全燃烧耗氧量相同
B.丙烯分子中三个碳原子处于同一直线上
C.乙烯和丙烯与HCI加成均有两种产物
D.以丙烯为单体加聚可以生成
难度: 简单查看答案及解析
-
常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的足
A.pH=2的硫酸溶液含有H+数目为0.0lNA
B.该反应释放SO2分子数目为
NA
C.反应中每摩尔Na2S2O3转移的电子数目为4NA
D.若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA
难度: 中等查看答案及解析
-
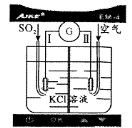
下列有关实验设计或操作正确且能达到目的的是

难度: 简单查看答案及解析
-
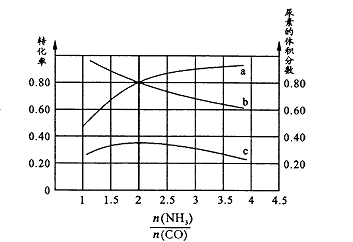
常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.常温下

B.pH=13时,溶液中不存在HC03-的水解平衡
C.pH由8~11时,
不变
D.pH=3时,有

难度: 简单查看答案及解析
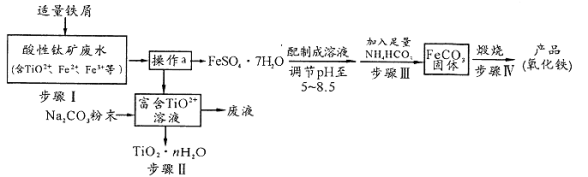




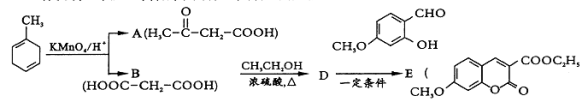
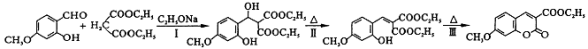
 中能与稀NaOH溶液反应的官能团是
中能与稀NaOH溶液反应的官能团是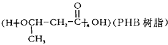 请写出反应合成线路______________。(无机试剂任用)
请写出反应合成线路______________。(无机试剂任用)