-
下列有关电化学原理的说法中,错误的是
A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极
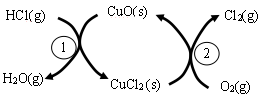
C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气
D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.过氧化钠和水反应:2O22—+2H2O=4OH-+O2↑
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
难度: 中等查看答案及解析
-
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
A.加入NH4HSO4固体,v(H2)不变,生成H2量不变
B.加入少量水,v(H2)减小,生成H2量减少
C.加入CH3COONa固体,v(H2)减小,生成H2量不变
D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少
难度: 中等查看答案及解析
-
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体 B.将溶液稀释到原体积的10倍
C.加入等体积0.2 mol·L-1氨水 D.降低溶液的温度
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.溶液中c(H
)越大,pH也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
难度: 中等查看答案及解析
-
常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积
A.同样多 B.HCl最多
C.HCl、HNO3一样多 D.CH3COOH最少
难度: 中等查看答案及解析
-
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法不正确的是
A.浓度均为0.1mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1mol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)增大
难度: 中等查看答案及解析
-
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
H++OH-逆向移动,c(H+)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下反应,起始时醋酸与锌反应的速率大
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
难度: 中等查看答案及解析
-
下列事实中一定不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④pH=1的CH3COOH溶液和pH=13的KOH溶液等体积混合,溶液呈酸性
⑤CH3COONa和稀H3PO4反应,生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3
⑦10ml0.1mol.L-1CH3COOH恰好与10ml0.1mol.L-1NaOH溶液完全反应
A.②⑦ B.②⑤ C.①③⑤ D.②④⑤⑥
难度: 中等查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是
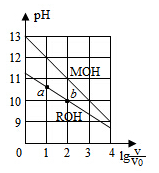
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
-
下列有关水的电离的说法正确的是
A.将水加热,KW增大,pH不变
B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大
C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小
D.向水中加入少量NaOH固体,恢复到原温度,水的电离被抑制,c(OH-)增大
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
难度: 中等查看答案及解析
-
用已知浓度的NaOH滴定未知浓度的HCl溶液时,正确的操作顺序是
①用水洗净滴定管
②将滴定管进行检漏
③用待装液润洗滴定管后装液
④调整起始读数并记录
⑤向锥形瓶中加入指示剂
⑥用标准液进行滴定
⑦从酸式滴定管中取一定体积的待测液
⑧记录滴定终点读数并重复实验2~3次
A.①②③④⑤⑥⑦⑧ B.①②③④⑦⑤⑥⑧
C.②①③④⑦⑤⑥⑧ D.②①③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
A.盛装标准液的滴定管未用标准液润洗
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡
难度: 中等查看答案及解析
-
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
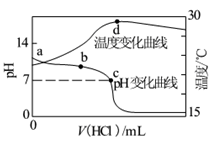
A.氨水的电离程度a>b>c
B.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
C.c点时消耗盐酸体积V(HCl)<20 .00ml
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热
难度: 中等查看答案及解析
-
水的电离平衡为H2O
H+﹢OH-,△H>0,下列叙述不正确的是
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中滴入稀醋酸,c(H+)增大
D.向水中加入少量固体NaClO,平衡逆向移动
难度: 中等查看答案及解析
-
100℃时。下列三种溶液:①0.001 mol·L-1氨水与0.001 mol·L-1HCl溶液等体积混合液②pH=3的HCl与pH=11的NaOH溶液等体积混合液 ③pH=11的氨水与pH=1的HCl溶液等体积混合液。其中呈酸性的是
A.① B.③ C.②③ D.①③
难度: 中等查看答案及解析
-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+ 3H2(g)
2NH3(g) △H=-92.4 kJ/mol
实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
3
0
放出热量b kJ
③
2
6
0
放出热量c kJ
下列叙述正确的是
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
难度: 中等查看答案及解析
-
部分弱电解质的电离平衡常数如下表,以下选项错误的是
化学式
NH3·H2O
CH3COOH
HCN
H2CO3
Ki(25℃)
1.8×l0—5
1.8×l0—5
4.9×l0—10
Ki1= 4.3×l0—7
Ki2= 5.6×l0—11
A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性
C.CN-+H2O+CO2→HCN+ HCO3-
D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者
难度: 困难查看答案及解析
-
下列离子方程式不正确的是
A.纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O
HCO3-+OH-
B.烧碱溶液与小苏打溶液混合:HCO3-+OH-=CO32-+H2O
C.硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO3
D.氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
难度: 中等查看答案及解析
-
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
难度: 中等查看答案及解析
-
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
A.反应放出的热量为0.2a kJ
B.平衡时H2O的转化率为40%
C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动
D.若将容器的体积压缩为1L,有利于该反应平衡正向移动
难度: 困难查看答案及解析
-
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
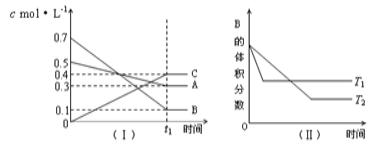
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
难度: 困难查看答案及解析
-
分析下图所示装置,下列叙述不正确的是
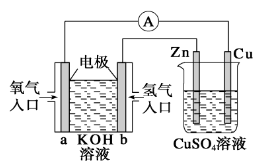
A.左边装置是燃料电池,右边装置是电镀池
B.电子流动方向:b→Zn→CuSO4(aq)→Cu→a
C.一段时间后,左端溶液浓度变小,右端溶液浓度不变
D.当锌片的质量变化12.8g时,a极消耗标准状况下的O2 2.24 L
难度: 中等查看答案及解析
-
据报道,最近苹果公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— =2CO32— + 6H2O,则下列说法错误的是
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析