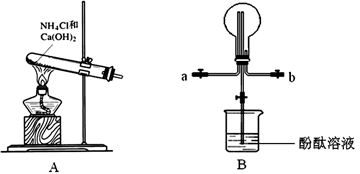
-
甲烷和氯气以物质的量1:1混合,在光照条件下,得到的产物是
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有①⑤ B.①②③④的混合物
C.只有②⑤ D.①②③④⑤的混合物
难度: 简单查看答案及解析
-
下列物质不属于“城市空气质量日报”报道内容的是( )
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
难度: 简单查看答案及解析
-
已知X+、Y2+、Z﹣、W2﹣四种离子具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A. 金属性:X>Y,还原性:Z﹣>W2﹣ B. 原子半径:X>Y>W>Z
C. 离子半径:Y2+<X+<Z﹣<W2﹣ D. 原子序数:Y>X>Z>W
难度: 中等查看答案及解析
-
下列说法中,正确的是 ( )
A. 18O原子核内的中子数为8 B. 16O2和18O2的化学性质几乎相同
C. H216O与H218O质子数不同 D. H2和D2 属于同位素
难度: 中等查看答案及解析
-
下列反应中,光照对反应几乎没有影响的是( )
A. 氯气与氢气的反应
B. 氯气与甲
烷的反应
C.氧气与甲烷的反应
D. 次氯酸的分解
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是( )
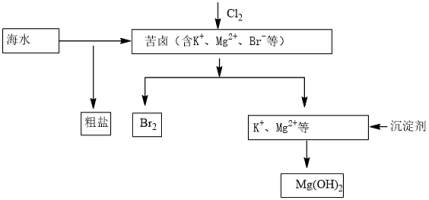
A.工业生产中常选用NaOH作为沉淀剂
B.粗盐可采用溶解、过滤和重结晶等过程进一步提纯
C.向苦卤中通入Cl2是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列现象和用途中,浓硫酸表现脱水性的是( )
A. 实验室制取氯气时浓硫酸作干燥剂 B. 浓硫酸使火柴梗变黑
C. 浓硫酸加到胆矾上,蓝色晶体变成白色粉末 D. 浓硫酸使Fe、Al钝化
难度: 中等查看答案及解析
-
铜粉放入稀硫酸中,加热后无明显现象发生,当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是
A、Fe2(SO4)3 B、Na2CO3 C、KNO3 D、FeSO4
难度: 简单查看答案及解析
-
根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
元素代号
A
B
C
D
E
原子半径/nm
0.186
0.143
0.089
0.104
0.074
主要化合价
+1
+3
+2
+6、-2
-2
A. E2-与B3+的核外电子数不可能相等 B. 氢化物的稳定性H2D﹥H2E
C. 最高价氧化物对应水化物的碱性A<C D. 离子半径大小A+<E2-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
B. 某物质在熔融态能导电,则该物质中一定含有离子键
C. 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
D. MgF2晶体中的化学键是共价键
难度: 中等查看答案及解析
-
38.4g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体22.4L(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0mol B.1.6 mol C.2.2 mol D.2.4 mol
难度: 中等查看答案及解析
-
下列由相关实验现象所推断出的结论中,正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华
C.Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
下列化工生产原理正确的是( )
①可以用电解熔融的氯化钠的方法来制取金属钠
②可以用钠加入氯化镁饱和溶液中制取镁
③电冶铝时,原料是氯化铝
④炼铁高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①③ C.① D.②③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1.8 g D2O含有NA个中子
B. 标准状况下,22.4 L己烷中共价键数目为19NA
C. 5.35 g NH4Cl固体中含有N—H键的个数为0.4NA
D. 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
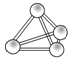
A.N4分子属于一种新型的化合物
B.N4分子中只含有非极性键
C.1molN4分子所含共价键数为4NA
D.N4沸点比P4(白磷)高
难度: 简单查看答案及解析
-
有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种。将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是( )
A.不能确定原气体中是否含有SO2
B.原气体中肯定有HCl
C.原气体中肯定没有CO2
D.原气体中肯定没有HBr、NO2
难度: 中等查看答案及解析
-
有一种盐A和KOH反应,生成有刺激性气味的气体B,B经过一系列氧化再溶于水可得到酸C,B和C反应又可以生成A,则A是
A.NH4Cl B.(NH4)2SO4 C.NH4NO3 D.(NH4)2CO3
难度: 简单查看答案及解析
-
下列关于丙烷结构、性质的推断中正确的是( )。
A. 丙烷的3个碳原子不在同一直线上 B. 丙烷可与氯水发生取代反应
C. 丙烷能使溴水、酸性KMnO4溶液都褪色 D. 丙烷可与强酸或强碱反应
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
难度: 中等查看答案及解析
-
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
难度: 中等查看答案及解析