-
下列说法中正确的是
A.熵增加且放热的反应一定是自发反应
B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应
C.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
D.非自发反应在任何条件下都不能发生
难度: 中等查看答案及解析
-
下列叙述中一定能判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变 B.正、逆反应速率改变
C.混合物中各组分的百分含量改变 D.混合体系的压强发生改变
难度: 中等查看答案及解析
-
下列叙述正确的是
A.反应NH3(g)+HCl(g)
NH4C1(s) ΔH<O在任何条件下均能自发进行
B.对于可逆反应N2(g)+3H2(g)
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.将A1C13溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为A1203
D.恒容密闭容器中进行的反应3A(g)
B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入铜块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2,可制得金属镁
难度: 中等查看答案及解析
-
在恒温、恒容的条件下,有反应2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6 mol/L,则以下叙述正确的是
A.两途径最终达到平衡时,体系内混合气的浓度相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2
难度: 中等查看答案及解析
-
下列关于电解质溶液的正确判断是
A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3可推知NaA溶液存在A-+H2O
HA+OH-
难度: 中等查看答案及解析
-
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
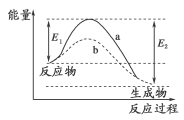
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量大于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,b的反应速率更快
难度: 中等查看答案及解析
-
甲烷燃料电池分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列说法正确的是
A.总反应式都为CH4+2O2===CO2+2H2O
B.H2SO4和NaOH的物质的量都不变,但浓度都减小
C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+
D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH-
难度: 中等查看答案及解析
-
将4 mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g)
2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是
A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.3 mol·L-1
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
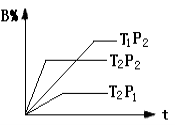
A.T1>T2,p1>p2,m+n>r,正反应吸热
B.T1<T2,p1<p2,m+n<r,正反应吸热
C.T1>T2,p1>p2,m+n<r,正反应放热
D.T1<T2,p1<p2,m+n>r,正反应放热
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ·mol-1
B.由N2(g)+3H2(g)
2NH3(g) △H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子 时,反应放出的热量小于92.4 kJ
C.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101 kPa时,4gH2完全燃烧生成液态水,放出571.6 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
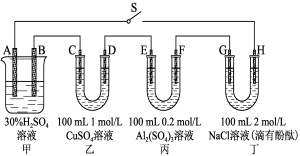
将下图所示实验装置的K闭合,下列判断正确的是
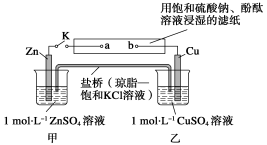
A.Cu电极上发生氧化反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(K+)增大 D.片刻后可观察到滤纸a点变红色
难度: 中等查看答案及解析
-
把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.CH3COOH溶液 B.NaCl溶液 C.NaOH溶液 D.FeCl3溶液
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.c(H+)=c(OH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者大于后者
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D.室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
难度: 中等查看答案及解析
-
25℃时,5 mL O.1 mol /l的 H2S04和15 ml O.1 mol/lNa0H溶液相混合并稀释至500 ml,所得溶液的pH为
A.12.3 B.11 C.3 D.1.7
难度: 中等查看答案及解析
-
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
序号
NaOH溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
20.00
0.00
8
②
20.00
20.00
6
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是
A.由水电离的c(H+):①=②>③=④
B.将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.①②的导电性不同,③④的导电性也不同
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①
难度: 中等查看答案及解析
-
下图曲线a和b是盐酸与氢氧化钠溶液相互滴定的曲线,下列叙述正确的是
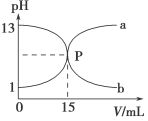
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3- )>c(CO32 -)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)= c(HCO3- )+2c(H2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32 -)>c(HCO3- )>c(OH-)>c(H+)
D.CH3COONa和CH3COOH混合溶液一定存在:c(Na+)= c(CH3COO-)=c(CH3COOH)>c(H+)= c(OH-)
难度: 中等查看答案及解析
-
下列说法正确的是
A.25 ℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
B.饱和小苏打溶液中:c(Na+)=c(HCO3-)
C.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
D.室温下,对于0.10 mol·L-1的氨水,用HNO3溶液完全中和后,溶液不显中性
难度: 中等查看答案及解析
-
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定正确的是
A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>b
C.若c(OH-)=c(H+),a>b D.若c(K+)<c(CH3COO-),a<b
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O
2H+ + Cl-+ ClO-
B.用铜做电极电解CuSO4溶液:2Cu2++2H2O
2Cu +O2↑+4H+
C.NaHS电离方程式:NaHS
Na+ + HS-
D.NH4Cl水解反应:NH4+ +2H2O
NH3·H2O + H3O+
难度: 中等查看答案及解析