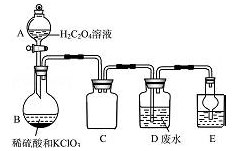
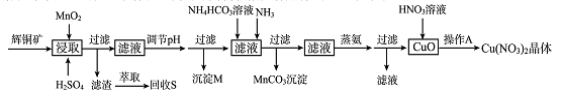
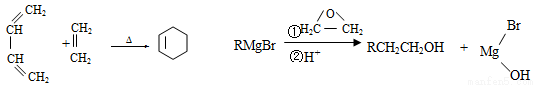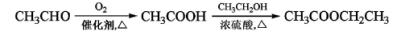-
化学与生产、生活密切相关,下列叙述错误的是
A.饱和Na2SO4溶液可以使蛋白质变性
B.大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染
C.从海带中提取碘单质的过程涉及氧化还原反应
D.镀锌铁桶镀层破损后铁仍不易被腐蚀
难度: 简单查看答案及解析
-
下列离子在给定条件下,可能大量共存的是
A.某无色透明的溶液中:Ca2+、NH4+、CO32—、HCOO—
B.溶解有AlCl3的溶液中:Na+、K+、SO42—、S2—
C.25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3—、I—
D.离子浓度均为0.1 mol/L的溶液中:Na+、Fe3+、CH3COO—、NO3—
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法中正确的是
A.46 g C2H6O中含有的C-H键数一定为5 NA
B.常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA
C.将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA
D.2 mol SO2和1 mol O2混合,所得气体的分子数为2NA
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”都正确的是
操作和现象
结 论
A
向盛有2mL 0.1mol/L AgNO3溶液的试管中,先滴几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液。试管中先出现白色沉淀,后出现淡黄色沉淀
Ksp(AgCl)< Ksp(AgI)
B
向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变
Fe(NO3)2与H2SO4不反应
C
在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色
CCl4可作为碘的萃取剂
D
测定饱和NaClO溶液、CH3COONa溶液的pH, pH(NaClO)> pH(CH3COONa)
弱酸的酸性:HClO < CH3COOH
难度: 困难查看答案及解析
-
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中正确的是
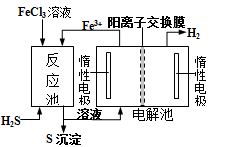
A.电解池中OH—从右槽迁移到左槽
B.H+在右槽发生氧化反应
C.左槽中发生的反应是:4OH—-4e—=O2↑ + 2H2O
D.常温常压下,反应中每转移1mol电子生成1g氢气
难度: 困难查看答案及解析
-
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导 率变化可以确定滴定反应的终点。右图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
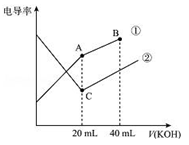
A.曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线
B.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)
C.在A点的溶液中有:c(CH3COO—)+ c(OH—)﹣c(H+)= 0.05 mol/L
D.在B点的溶液中有:c(K+)> c(OH—)> c(CH3COO—)> c(H+)
难度: 困难查看答案及解析
-
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)
CH3OH(g)。反应的平衡常数如下表:
温度/℃
0
100
200
300
400
平衡常数
667
13
1.9×10-2
2.4×10-4
1×10-5
下列说法正确的是
A.该反应的△H > 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D.t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
难度: 困难查看答案及解析