-
下列反应的离子方程式书写正确的是
A.硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
B.向澄淸石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3+H2O
C.向 Ca(C1O)2 溶液中通入少量CO2:2ClO-+CO2+ H2O=2HC1O+CO32-
D.用稀硝酸除去试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O
难度: 中等查看答案及解析
-
《神农本草经》中记载“丹沙味甘微寒,治身体五脏百病,能化为汞”,丹沙即为丹砂,《抱朴子·金丹》中记载“凡草木烧之即烬,而丹砂烧之成水银,积变又还成丹砂,此处的丹砂(沙)的主要成分为
A.Ag2S B.HgS C.HgCl2 D.AgCl
难度: 中等查看答案及解析
-
过氧化钙(CaO2)作为食品添加剂,具有无毒安全、价格低廉、效果明显等优点。回答有关CaO2的说法错误的是
A.具有氧化性 B.具有还原性 C.具有漂白性 D.含有极性键
难度: 中等查看答案及解析
-
下列化学式能真实表示物质分子组成的是( )
A. SO2 B. SiC C. KCl D. NaOH
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A. 石英的分子式:SiO2
B. NH4Cl 的电子式:
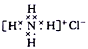
C. Cr原子的基态简化电子排布式为[Ar]3d54s1
D. S原子的外围电子排布图为

难度: 中等查看答案及解析
-
下列各组晶体中,化学健种类相同,晶体类型也相同的是( )
A. SO2与SiO2 B. NaCl与HCl C. CO与NO D. CCl4与KCl
难度: 中等查看答案及解析
-
下列氧化还原反应中氧化剂和还原剂不是同一种物质的是( )
A. 2H2O
2H2O+O2↑ B. 3Cl2+6NaOH
5NaCl+NaClO3+3H2O
C. 2Na2O2+2CO2=2Na2CO3+O2 D. 2H2S+ H2SO4(浓)=S↓+SO2↑+2H2O
难度: 中等查看答案及解析
-
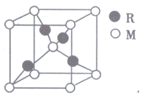
某离子晶体的晶胞为正三棱柱(如图所示),该晶体中A、B、C三种微粒的数目之比为( )
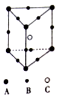
A. 3∶9∶4 B. 1∶4∶2 C. 6∶9∶1 D. 3∶8∶4
难度: 困难查看答案及解析
-
下列变化过程中,各种物质破坏的作用力不正确的是( )
选项
变化过程
破坏的作用力
A
干冰升华
分子间作用力
B
钠熔化
金属键
C
氢氧化钠的溶解
离子键
D
水汽化
共价键
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为1.5NA B. 60g SiO2中含有Si-O键的个数为2NA
C. 124 g P4中含P-P键的个数为4 NA D. 12 g金刚石中含C-C键的个数为NA
难度: 中等查看答案及解析
-
下列实验操作或方法中,不合理的是( )
A. 用丁达尔现象区分氯化钠溶液和淀粉溶液
B. 用重结晶法来提纯含有少量氯化钾杂质的硝酸钾晶体
C. 分别将SO2和Cl2通入滴有酚酞的氢氧化钠溶液中,验证两者的漂白性
D. 通过饱和碳酸氢钠溶液除去CO2中的HCl气体
难度: 中等查看答案及解析
-
下列化学操作中不正确的是( )
①配制溶液时,先向容量瓶中加入浓H2SO4,再加水稀释至刻度线
②向试管中滴加溶液时,为防止液体溅出,可将胶头滴管伸入试管内部
③闻未知气体气味时,可直接把集气瓶盖打开,放在鼻子下闻
④熄灭酒精灯时,应用扇子扇灭,而不能用嘴吹灭
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是( )
A. 加入铝粉能产生氢气的溶液:NH4+、K+、HCO3-、Br-
B. 含有KSCN的溶液: Na+、Fe3+、SO32-、OH-
C. c(KNO3)为 1.0 mol • L-1 的溶液: H+、Fe2+、C1-、SO42-
D. pH=14的溶液:Na+、K+、NO3- 、AlO2-
难度: 困难查看答案及解析
-
羰基硫是一种有臭鸡蛋气味的无色气体,易燃。常温下,在恒容密闭容器中,将CO和H2S按1:1混合加热可得到羰基硫和氢气。恢复至常温,容器内压强等于反应前的压强。下列说法不正确的是
A.若反应过程转移0.2mol电子,则生成0.1mol羰基硫
B.CO和H2S的反应中,H2S作还原剂
C.羰基硫的化学式为COS,是一种共价化合物
D.1mol羰基硫完全燃烧,消耗1.5mol氧气
难度: 简单查看答案及解析
-
关于金属元素的特征,下列叙述正确的是( )
①金属元素的原子只有还原性,离子只有氧化性②金属元素在化合物中一般显正价 ③金属性越强的元素相应的离子氧化性越弱④价电子越多的金属原子的金属性越强( )
A. ①② B. ②③ C. ①④ D. ③④
难度: 中等查看答案及解析
-
下列关于晶体的说法正确的是( )
A. 离子晶体中一定含金属阳离子
B. 只要含有金属阳离子的晶体就一定是离子晶体
C. 在共价化合物分子中,各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体的熔点低
难度: 中等查看答案及解析
-
下列实验操作或仪器的用法中正确的是( )

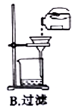
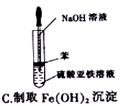
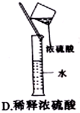
难度: 中等查看答案及解析
-
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中,某种石墨间隙化合物的化学式可写作CxK,其平面图形如图所示,则x的值为( )
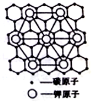
A. 8 B. 12 C. 24 D. 60
难度: 中等查看答案及解析
-
如图所示的甲、乙两个装置,均挤压胶头滴管,一段时间后两装置中的气球都明显胀大(忽略液体体积气球体积的影响),则滴管和烧瓶中所有试剂可能是( )
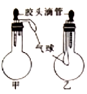
选项
甲
乙
滴管
烧瓶
滴管
烧瓶
A
浓硫酸
Fe
NaOH溶液
SO2气休
B
双氧水
MnO2
AgNO3溶液
HCl气体
C
浓硝酸
Al
H2O
氨气
D
氨水
CaO
稀盐酸
NaCO3
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某些物质的熔点数据如下表,据此做出的下列判断中错误的是( )
Na2O
NaCl
AlF3
AlCl3
920℃
801℃
1291℃
190℃
BCl3
SO2
CO2
SiO2
-107℃
44.8℃
-57℃
1723℃
A. 表中BCl3和CO2均是分子晶体 B. 铝的化合物的晶体均是离子晶体
C. 同族元素的氧化物可形成不同类型的晶体 D. 不同族元素的氧化物可形成相同类型的晶体
难度: 困难查看答案及解析
-
某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A. 当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B. 还原性:CN->Cl-
C. CN-的电子式为
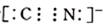
D. 该反应中氧化剂和还原剂的物质的量之比是2∶5
难度: 困难查看答案及解析
-
下列有关说法正确的是
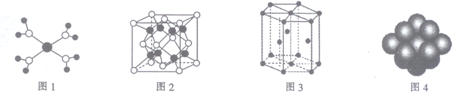
A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
难度: 中等查看答案及解析
-
下列实验操作及预期结果均正确的是( )
选项
实验操作
预期结果
A
将湿润的NH3通过盛有无水CaCl2的干燥管
可得到干燥的NH3
B
将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中
两者均能使KMnO4溶液褪色
C
Na2O2与湿润的红色试纸接触
试纸只变蓝不褪色
D
将CO2通入CaCl2溶液中
可得到白色沉淀
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O22-代替(如图),晶体中含有的哑铃形O22-使晶胞沿一个方向拉长。下列对于KO2晶体结构的描述正确的是( )
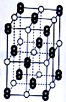
A. 与K+距离最近且相等的O2-共有4个 B. KO2的熔点比RbO2的熔点低
C. 与K+距离最近且相等的K+有12个 D. 一个KO2晶胞的质量为284 g
难度: 困难查看答案及解析
-
化学美无处不在,下图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
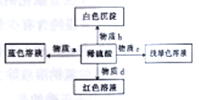
选项
物质a
物质b
物质c
物质d
A
Cu2(OH)2CO2
Ba(OH)2
Fe(OH)3
酚酞试液
B
CuO
NaAlO2
Fe2O3
石蕊试液
C
Cu2O
BaCl2
Fe2O3和 Cu
酚酞试液
D
Cu(OH)2
Ba(NO3)2
Fe(OH)2
石蕊试液
A. A B. B C. C D. D
难度: 困难查看答案及解析