-
酸雨给人类带来了种种灾难,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能
A.①②④ B.①②③ C.①②③④ D.①③④
难度: 简单查看答案及解析
-
下表中关于物质分类的正确组合是
类别
组合
酸性
氧化物
碱性
氧化物
电解质
强电解质
高分子
物质
A
CO2
CuO
氨气
NH3·H2O
葡萄糖
B
SO3
Na2O
稀硫酸
NaOH
果糖
C
SO2
CaO
冰醋酸
KOH
纤维素
D
N2O5
Na2O2
α-丙氨酸
Cu(OH)2
聚乙烯
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”都正确的是
操作和现象
结论
A
切开金属钠,钠表面的银白色会逐渐变暗
Na在空气中会生成Na2O2
B
向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变
Fe(NO3)2与H2SO4不反应
C
SO2通入酸性KMnO4溶液,溶液褪色
SO2具有漂白性
D
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述中不正确的是
A.常温下,46 g 红棕色二氧化氮气体中含有N、O原子个数和为3NA
B.标准状况下,1 NA CH3Cl所占的体积约为22.4 L
C.N2(g)+3H2(g)
2NH3(g) ΔH=-a kJ/mol,现向一密闭容器中通入2 NA个氨气分子反应完全后,吸收a kJ热量
D.足量铜与1 L 18mol·L-1浓硫酸反应可以得到SO2的分子总数小于9 NA
难度: 中等查看答案及解析
-
下列离子方程式或化学方程式与所述事实相符且正确的是
A.硫酸与氢氧化钡反应的中和热化学反应方程式为:
H2SO4(aq)+
Ba(OH)2(aq)=
BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol
B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- = H2O
C.以金属银为阳极电解饱和硫酸铜溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
难度: 困难查看答案及解析
-
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
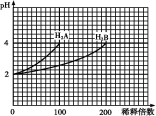
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
在2 L的密闭容器中进行如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),有如下数据:
实验
温度/℃
起始量/mol
平衡量/mol
CO
H2O
CO2
H2
CO2
1
650
2.0
1.0
0
0
0.8
2
800
2.0
2.0
0
0
1.0
下列说法正确的是
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=
D.实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol
难度: 中等查看答案及解析
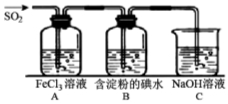
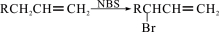 。
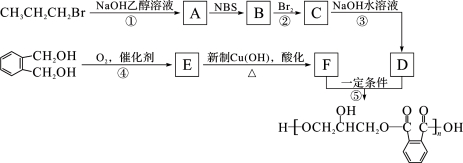
。
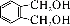 的同分异构体中同时符合下列条件的芳香族化合物共有_____种。
的同分异构体中同时符合下列条件的芳香族化合物共有_____种。