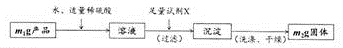
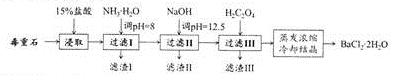
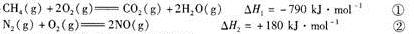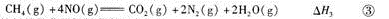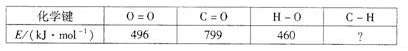-
近年来,我国发生了“三聚氰胺”奶粉事件、天津港化学品爆炸事故等多起公共安全问题,造成公众对化学学科的误解,特别是央视最近播出的某国产化妆品的一段广告,15秒内洗脑般重复“我们恨化学”这句话。作为一位高中生,对以上事件你怎么看
A.“三聚氰胺”奶粉事件是化学问题,不是商家的道德问题
B.爆炸一定是化学变化
C.某国产化妆品的生产不使用任何化学原理和方法
D.我们学习化学学科,应该做到:准确理解、辩证看待以及正面传播它
难度: 简单查看答案及解析
-
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是

A.该有机物的分子式为C26H22
B.该有机物属于苯的同系物
C.该有机物的一氯代物有4种
D.该有机物既可发生氧化反应,又可发生还原反应
难度: 中等查看答案及解析
-
以下数值等于阿伏加德罗常数值的是
A.6g石墨中的C-C键数目
B.常温常压下,17gND3中所含分子数目
C.向含0.2molNH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目
D.0.1mol羟基(-OH)中所含电子数目
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A.Fe(N03)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
B.浓烧碱溶液中加入铝片:2A1+20H-=2AlO2-+H2
C.H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-=BaSO4+H2O
D.将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3=[Cu(NH3)4]2+++2OH-
难度: 困难查看答案及解析
-
锌铜原电池装置如图所示,其中阴离子交换膜只允许阴离子和水分子通过,下列有关叙述正确的是
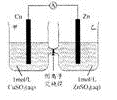
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池溶液的总质量增加
C.电池工作一段时间后,乙池的c(Zn2+)>c(SO42-)
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是

难度: 中等查看答案及解析
-
常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度为0.2mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.醋酸浓溶液加少量水稀释,
几乎不变
D.amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b
难度: 困难查看答案及解析