-
下列操作中正确的是
A.用试管取出试剂瓶中Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中
B.过滤时,漏斗下端紧贴烧杯内壁
C.加热试管内物质时,试管底部与酒精灯灯芯接触
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A.在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
难度: 简单查看答案及解析
-
下列仪器: ①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是
A.500mL溶液中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.1NA个K+离子
C.1L溶液中K+离子浓度是0.2mol/L
D.2L溶液中SO42-离子浓度是0.4mol/L
难度: 中等查看答案及解析
-
有K2SO4和Al2(SO4)3的混合溶液,其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为
A.0.1mol/L B.0.15mol/L C.0.2mol/L D.0.25mol/L
难度: 中等查看答案及解析
-
配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是
A.容量瓶中原有少量蒸馏水 B.溶解所用的烧杯未洗涤
C.称量时左码右物 D.定容时俯视观察液面
难度: 简单查看答案及解析
-
电子排布有能级顺序,若以E(nl)表示某能级的能量,以下各式中正确的是
A.E(4s)>E(3d)>E(3Px)>E(3Py)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(5s)>E( 4f)>E(3Px)=E(3Py)
D.E(5s)>E(4s)>E( 4f)>E(3d)
难度: 简单查看答案及解析
-
下列原子轨道表示式中,表示氧原子的基态电子轨道排布式正确的是
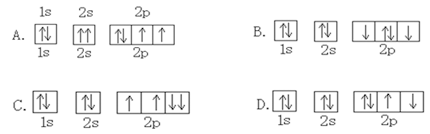
难度: 中等查看答案及解析
-
下列物质的分子中既有σ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥ C.③⑤⑥ D.①③⑥
难度: 中等查看答案及解析
-
下列化合物中既含有离子键又含有极性共价键和配位键的是
A.NaCl B.H2SO4 C.Na2O2 D.NH4Cl
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法不正确的是
A.18gH2O中含有的电子数为10 NA
B.46gNO2和46gN2O4含有的原子数均为3 NA
C.1L 1mol·L-1的盐酸中,所含HCl分子数为NA
D.标准状况下,11.2L O3中含1.5 NA个氧原子
难度: 中等查看答案及解析
-
下列针对H3O+的说法中正确的是
A.中心原子上的孤电子对数为2
B.O原子采用sp2杂化, 空间构型为三角锥形
C.离子中存在配位键
D.纯水呈中性, 纯水中不存在H3O+微粒
难度: 中等查看答案及解析
-
对于某些离子的检验及结论正确的是
A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32—
B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42-
C.加盐酸无现象,再加氯化钡溶液有白色沉淀产生,原溶液中一定有SO42-
D.加入AgNO3溶液后有白色沉淀,原溶液中一定有Cl—
难度: 中等查看答案及解析
-
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 中等查看答案及解析
-
下列关于杂化轨道的叙述中,不正确的是
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
C.杂化前后的轨道数不变,但轨道的形状发生了改变
D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
难度: 中等查看答案及解析
-
下列含有极性键的非极性分子是
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
A.②③④⑤ B.①③④⑤ C.①③④ D.以上均不对
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2 B.NaCl和HCl C.CCl4和KCl D.CO2和H2O
难度: 简单查看答案及解析
-
下列说法正确的是
A.P和S属于第三周期元素,P的第一电离能比S小
B.Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强
C.C和Si属于第ⅣA族元素,Si比C更容易和氢气反应
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点表,有关的判断正确的是
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8 ℃
1291 ℃
190 ℃
2073 ℃
-107 ℃
-57 ℃
1723 ℃
A.只要含有金属阳离子的晶体就一定是离子晶体
B.AlF3 和AlCl3 晶体熔化时,克服的微粒间作用力类型相同
C.同族元素的氧化物不可能形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
难度: 中等查看答案及解析
-
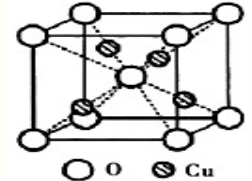
最近发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示.顶角和面心的原子是M原子,棱的中心和体心的原子是N原子,它的化学式为
A.M4N4 B.MN C.M14N13 D.M4N5
难度: 中等查看答案及解析