-
化学与生产、生活密切相关,下列说法正确的是
A.淀粉溶液、豆浆、雾和饱和食盐水均可发生丁达尔现象
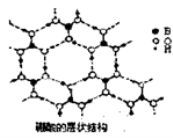
B.氮化硅(Si3N4)、氧化铝(Al2O3)、碳化硅(Sic)和二氧化锆(ZrO2)都可用作制高温结构陶瓷的材料
C.绿色化学的核心是利用化学原理治理环境污染
D.光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
①将过量SO2气体通入氨水中SO2+NH3·H2O=NH4++HSO3-
②用铁电极电解饱和食盐水:2Cl-+2H2O
2OH-+H2↑+Cl2↑
③向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3+2H2O+CO32-
④钢铁发生吸氧腐蚀正极的电极反应:2H2O+O2+4e-=4OH-
⑤硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO+6H2O
A.②③⑤ B.①③⑤ C.①④⑤ D.②④⑤
难度: 中等查看答案及解析
-
仅用下表提供的仪器和药品,就能达到相应实验目的的是
编号
仪器
药品
实验目的
A
托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒
NaCl固体、蒸馏水
配制一定质量分数的NaCl溶液
B
分液漏斗、烧瓶、锥形瓶、导管及橡皮塞
盐酸、大理石、硅酸钠溶液
证明非金属性:Cl>C>Si
C
酸式滴定管、胶头滴管、铁架台(带铁夹)
已知浓度的盐酸、待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
烧杯、分液漏斗、胶头滴管、铁架台
待提纯的AlCl3溶液、NaOH溶液
提纯混有MgCl2杂质的AlCl3溶液
难度: 中等查看答案及解析
-
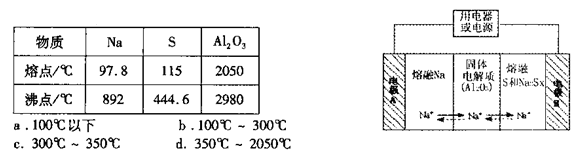
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是
A.原子半径W>Z>Y>X>M
B.将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种
C.由X、Y、Z、M四种元素共同形成的化合物中一定有共价健可能有离子键
D.CaX2、CaM2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
难度: 困难查看答案及解析
-
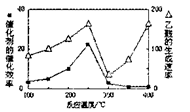
一在密闭容器中进行反应CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
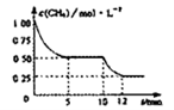
A.0~5min内,v(H2)=0.1mol/L·min
B.反应进行到12min时,CH4的转化率为25%
C.恒温下,缩小容器体积,平衡后H2浓度减小
D.10 min时.改变的外界条件可能是升高温度
难度: 困难查看答案及解析
-
下列有关电解质溶液中徽粒的物质的量浓度关系正确的是
A.在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1mol/LNa2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3)
C.向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LnaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
根据下列各图曲线表征的信息,得出的结论不正确的是
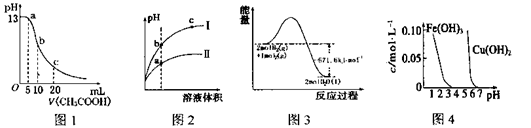
A.图l表示常温下向体积为10 mL 0. 1 mol•L-1NaOH溶液中逐滴加入0. 1 mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸.II表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的然烧热为285. 8kJ mol-1
D.由图4得出若除去CuSO4洛液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的PH至4左右
难度: 极难查看答案及解析