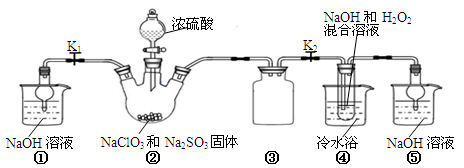
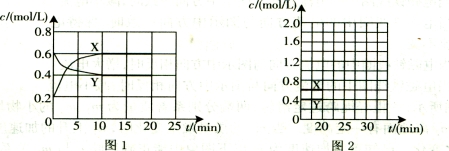-
化学与生活、社会密切相关。下列说法正确的是( )。
A.Si常用做信息高速公路的骨架—— 光导纤维的主要材料
B.近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 简单查看答案及解析
-
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是
A.B与A只能组成BA3化合物
B.C、D、E形成的化合物与稀硫酸可能发生氧化还原反应
C.A、B、C形成的化合物一定不能发生水解反应
D.E的氧化物对应的水化物一定有强的氧化性
难度: 中等查看答案及解析
-
在2 L的密闭容器中发生反应xA(g)+yB(g)
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)
zC(g)的ΔH<0,且a=2
难度: 中等查看答案及解析
-
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是( )。
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中
2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:
c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
难度: 中等查看答案及解析
-
(1)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
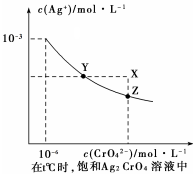
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
难度: 中等查看答案及解析
-
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )。

A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
难度: 中等查看答案及解析
-
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )。
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
难度: 困难查看答案及解析