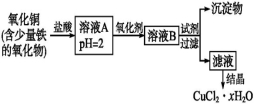
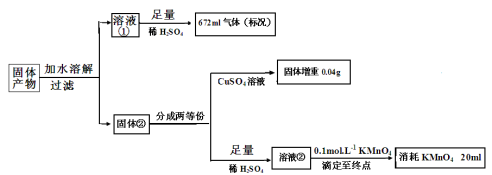
-
化学与生产、生活、社会密切相关。下列有关说法中正确的是
A.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
B.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
C.鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排
D.焰火“脚印”、“笑脸”使北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”的知识相关,焰色反应是化学变化
难度: 简单查看答案及解析
-
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx,分解成无害的N2和H2O的干法脱硝技术,反应原理为:
① 6NO+4NH3=5N2+6H2O ② 6NO2+8NH3=7N2+12H2O ③ NO+NO2+2NH3=2N2+3H2O
下列说法正确的是
A.NO2为酸性氧化物
B.H2O很稳定是因为水分子之间存在氢键
C.反应③中每生成22.4 LN2,转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
难度: 中等查看答案及解析
-
下列褪色现象中,其中一项与其他三项褪色原理不同的是
A.二氧化硫能使酸性高锰酸钾溶液褪色
B.氯水能使甲基橙褪色
C.浓硝酸能使石蕊试液褪色
D.臭氧能使品红溶液褪色
难度: 简单查看答案及解析
-
用14C标记的一种C60羧酸衍生物,在特定条件下会断裂DNA抑制艾滋病毒的繁殖。以下有关14C的叙述正确的是
A.与12C60的碳原子化学性质不同 B.与15N含的中子数相同
C.与12C60互为同素异形体 D.与12C、13C互为同系物
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是
A.碘升华 B.NaOH熔化 C.NaHSO4溶于水 D.酒精溶于水
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.苯甲醛:
B. Mg2+的结构示意图:
C.CO2的电子式:
D.核内有8个中子的碳原子:
C
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.1mol甲基(-CH3)含有9NA个电子
B.标准状况下,22.4LSO3含有的原子数为4NA
C.0.10mol.L-1NaOH溶液中含有OH-离子数是0.1NA
D.5.6g Fe与2.24LCl2充分反应转移电子数为0.2NA
难度: 中等查看答案及解析
-
某实验过程如图所示,则图③试管中的现象是
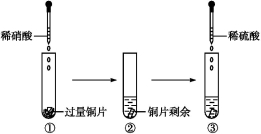
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq)
AlCl3
Al
② NH3
NO
HNO3
③NaCl(饱和)
NaHCO3
Na2CO3
④FeS2
SO3
H2SO4
A.②③ B.①④ C.②④ D.③④
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
难度: 中等查看答案及解析
-
原子序数依次增大的四种短周期元素X、Y、Z、M。其中Z是金属元素,X的原子半径小于Y,Y与M同主族,Y的质子数为M的1/2。下列说法一定正确的是
A.X与M的原子序数之差为31
B.Y的离子半径小于Z的离子半径
C.由X与Z组成的化合物,可与水反应放出X2
D.由M与Y组成的化合物,其水化物是强酸
难度: 中等查看答案及解析
-
下图所示的实验,能达到实验目的的是
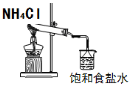
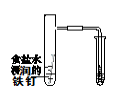
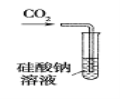

① ② ③ ④
A.实验①制取的氨气溶解在饱和NaCl溶液
B.实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氢腐蚀
C.实验③可用于证明碳的非金属性比硅强
D.图④是实验室洗涤胶头滴管的操作
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
Fe3+有氧化性
实验室常用KSCN溶液检验Fe3+
B
SO2有较强的还原性
SO2可使酸性KMnO4溶液褪色
C
浓硫酸可干燥NO和SO2
NO和SO2还原性都弱
D
浓硫酸有吸水性
浓硫酸可用于干燥氨气
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水
A.①② B.②③ C.①④ D.④⑤
难度: 中等查看答案及解析
-
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%, SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
难度: 中等查看答案及解析
-
某溶液中含有NH4+、SO32-、SiO32-、Br - CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤溶液中共发生了2个氧化还原反应
A.①②③④ B.①②③④⑤ C.①③④⑤ D.②④⑤
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论错误的是
选
项
实验操作
实验现象
结论
A
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有完全变质
B
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水
实验现象1:
上层溶液不变红,下层溶液呈紫红色
实验现象2:
上层溶液变红
氧化性:Br2>Fe3+>I2
C
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al的
D
取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液
溶液变为红色
绿矾部分或全部被氧化
难度: 困难查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是




图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.澄清石灰水中滴加少量NaHCO3: Ca2++ 2OH++2HCO3-= CaCO3↓+2H2O+ CO32-
D.向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75ⅹ10-5
Ka=2.98ⅹ10-8
Ka1=4.3ⅹ10-7
Ka2=5.61ⅹ10-11
Ka1=1.54ⅹ10-2
Ka2=1.02ⅹ10-7
下列离子方程式正确的是
A.少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HclO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++ HCO3-=CO2↑+2H2O
难度: 困难查看答案及解析
-
某溶液中只含下表离子中的几种(不考虑水的电离与离子水解),且各离子的物质的量浓度均为0.1mol/L。
阳离子
K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+
阴离子
OH- Cl- Al02- CO32- SiO32- SO42-
某同学进行了如下实验(必要时可加热)
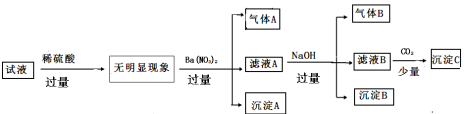
下列说法正确的是
A.原溶液中只含有NH4+ Fe2+ Cl- SO42-
B.由沉淀A推断原溶液中一定含有SO42-
C.滤液A中可能含有K+ Al3+ Cl-
D.沉淀B中一定含有Mg(OH)2
难度: 极难查看答案及解析