-
下列热化学方程式书写正确的是( )
A.2SO2+O2
2SO3;△H=-196.6kJ/mol
B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol
C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ
难度: 简单查看答案及解析
-
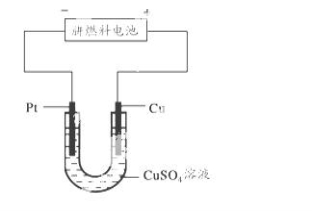
下面有关电化学的图示,完全正确的是( )
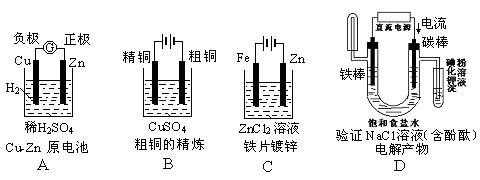
难度: 简单查看答案及解析
-
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜。一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是 ( )

A.质量增加6.4g B.质量增加12.8g
C.质量减少6.4g D.质量减少12.8g
难度: 困难查看答案及解析
-
用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液
的pH增大的是( )
A.KCl B.NaOH C.Na2SO4 D.H2SO4
难度: 中等查看答案及解析
-
设C+CO2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液( )
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
难度: 中等查看答案及解析
-
反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是( )
A.低温下自发进行,高温下非自发进行 B 高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D任何温度下均为自发进行
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c + d
难度: 困难查看答案及解析
-
关于化学平衡常数K,下列说法不正确的是 ( )
A.K只随温度的改变而改变
B.K>Q(Q为浓度熵)平衡正向移动
C.正、逆反应的平衡常数数值相同,符号相反
D.K值变化平衡一定发生移动
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:H2(g)+I2(g)
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示。符合图示的正确判断是( )
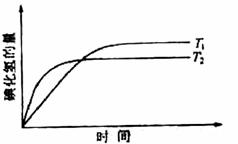
A.T1>T2,△H>0 B.T1>T2,△H<0
C. T1<T2,△H>0 D. T1<T2,△H<0
难度: 中等查看答案及解析
-
t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为:
,有关该平衡体系的说法正确的( )
A.升高温度,平衡常数K一定增大
B.增大压强,W(g)质量分数增加
C.该反应的化学反应方程式为X+2Y
2Z+2W
D.增大X(g)浓度,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
下列操作会导致实验结果偏高的是
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在分子
C.进行中和滴定时,锥形瓶不能用所盛溶液润洗
D.不同的弱电解质只要物质的量浓度相同,电离程度也相同
难度: 简单查看答案及解析
-
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
难度: 中等查看答案及解析
-
在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B.通入少量氯化氢气体
C.升高温度 D.加入少量氢氧化钠固体
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol•L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
难度: 中等查看答案及解析
-
下列关于pH相同的盐酸和醋酸溶液的说法正确的是 ( )
A.中和相同体积的两种酸溶液所需NaOH的物质的量相同
B.加入等质量的锌粉,反应过程中放出H2的速率相同
C.两种溶液中由水电离出来的c(H+)不相同
D.分别用蒸馏水稀释相同倍数后,盐酸的pH大于醋酸的pH
难度: 简单查看答案及解析
-
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
难度: 中等查看答案及解析