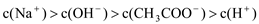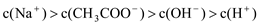-
已知反应X+Y═M+N为放热反应,对该反应的说法正确是
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因为该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
难度: 中等查看答案及解析
-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则电解质溶液可能是( )
A. Ba(OH)2 B. HCl C. Na2 SO4 D. AgNO3
难度: 中等查看答案及解析
-
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液 C.(NH4)2SO4粉末 D.K2SO4固体
难度: 中等查看答案及解析
-
向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大 D.AgCl的溶解度、Ksp均增大
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A. 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和浓度与体积均相同的盐酸和醋酸溶液,后者消耗NaOH的物质的量较大
D. 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
难度: 中等查看答案及解析
-
下列关于盐溶液呈酸碱性的说法错误的是( )
A. 盐溶液呈酸碱性的原因是破坏了水的电离平衡
B. NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C. 在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D. 水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
下列有关说法不正确的是
A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l)
H+(aq)+OH-(aq) ΔH= +57.3 kJ·mol-1
D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B. 相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2∶1
C. 已知2SO2(g)+ O2(g)
2SO3 (g)△H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
难度: 中等查看答案及解析
-
某温度下,对可逆反应2X(g) + Y(g)
3Z(g) + W(s) ΔH>0 的叙述正确的是
A. 加入少量W,逆反应速率增大,平衡向左移动
B. 增大压强,正反应速率增大,逆反应速率减小
C. 温度、体积不变,充入He气增大压强,反应速率会加快
D. 升高温度,混合气体的平均相对分子质量减小
难度: 中等查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl--e-===AgCl
B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“水”电池的负极移动
D. AgCl是还原产物
难度: 中等查看答案及解析
-
m A+n B
p C+q D,该反应在其它条件不变的情况下,以T1和T2表示不同温度,Ⅰ表示T1时的平衡状态,Ⅱ表示T2时的平衡状态,则下列叙述符合图示的是
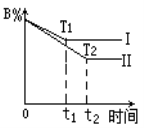
A. 正反应是吸热反应 B. T1>T2
C. 逆反应是放热反应 D. T2>T1
难度: 简单查看答案及解析
-
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)
Ca(OH)2(aq)
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
A.n(Ca2+)增大 B.c(Ca2+)不变 C.n(OH-)增大 D.c(OH-)减小
难度: 中等查看答案及解析
-
实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于1,0.1 mol/L某一元碱(BOH)溶液里:
=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
A.c(B+)>c(A-)>c(OH-)>c(H+)
B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(H+)>c(A-)>c(OH-)>c(B+)
D.c(B+)>c(A-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应
X(g) + Y(g)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表:
t /min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2min的平均速率v(Z) =4.0×10-3mol/(L•min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆) > v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 中等查看答案及解析
-
常温下,将 pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如图,下列有关叙述正确的是( )

A. 曲线I为醋酸稀释时pH值变化曲线
B. b点溶液中水的电离程度比c点溶液中水的电离程度大
C. a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气少
D. a点时,若都加入相同大小的锌粒,此时与盐酸反应的速率大
难度: 中等查看答案及解析
-
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③苯酚钠三份溶液中的c(Na+):③>②>①
B.0.lmol·L -1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+ c(HA-)+c(H2A)
C.上图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+) +c(CH3COO-) +2c(CH3COOH)
难度: 困难查看答案及解析