-
下列有关叙述中正确的是
A.同一弱电解质溶液,温度不同时,导电能力相同
B.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
C.强电解质在水溶液中的电离过程是不可逆的
D.易溶于水的电解质一定是强电解质
难度: 简单查看答案及解析
-
下列关于电解质说法正确的是
A.在熔融状态或溶于水能导电的物质叫电解质
B.电解质在通电时发生电离
C.熔融的KOH导电,所以KOH是电解质
D.NaCl晶体不导电,所以NaCl不是电解质
难度: 中等查看答案及解析
-
下列电离方程式正确的是
A.NaHSO4
Na++H++SO42- B.HCO3-+H2O=== H3O++CO32-
C.HClO===H++ClO- D.H2S
H++HS-
难度: 简单查看答案及解析
-
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是
A.醋酸的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等
难度: 中等查看答案及解析
-
在甲酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L
B.甲酸能与水以任意比互溶
C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应
D.在相同条件下,甲酸的导电性比强酸溶液的导电性弱
难度: 中等查看答案及解析
-
用0.01 mol·L-1NaOH溶液完全中和pH=3的下列溶液各100 mL,需NaOH溶液体积最大的是
A.盐酸 B.醋酸 C.硝酸 D.硫酸
难度: 中等查看答案及解析
-
等体积、等物质的量浓度的盐酸和醋酸比较,下列说法错误的是
A.溶液中pH醋酸比盐酸大
B.与足量的锌粉反应产生的氢气体积相同
C.与足量锌粒反应时,一开始盐酸的速率快
D.能中和NaOH溶液的物质的量醋酸较少
难度: 中等查看答案及解析
-
在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
A.加入水时,溶液中c(OH-)/ c(NH3·H2O)增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大
D.降低温度,溶液中c(NH4+)增大
难度: 中等查看答案及解析
-
下列图中,能正确表示饱和H2S溶液中通入过量SO2后溶液导电情况的是
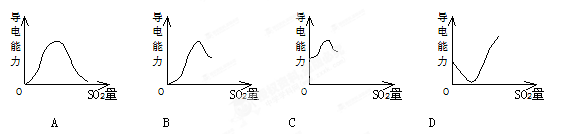
难度: 中等查看答案及解析
-
常温下,若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
难度: 中等查看答案及解析
-
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5 mol·L-1的盐酸
C.0.5 mol·L-1的CH3COOH溶液 D.0.5 mol·L-1 的KCl溶液
难度: 中等查看答案及解析
-
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶 液的体积之比为
A.11:1 B.9:1 C.1:11 D.1:9
难度: 中等查看答案及解析
-
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是
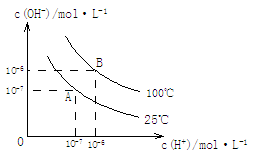
A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7
C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH等于7
D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7
难度: 中等查看答案及解析
-
常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2 mol/L的盐酸与0.1 mol/L的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是
A.a>b=c B.a>c>b C.c>b>a D.b>c>a
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
难度: 中等查看答案及解析
-
下列叙述正确的是
A、常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B、常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C、氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D、常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
难度: 中等查看答案及解析
-
用0.1 mol/L NaOH溶液滴定0.1 mol/L盐酸,如达到滴定终点时不慎多加1滴NaOH溶液(1滴溶液体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
难度: 中等查看答案及解析
-
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)·c(OH-)= 10-22,则该小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
A.13 B.12 C.11 D.10
难度: 中等查看答案及解析
-
在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g 锌粒,则下图所示比较符合客观事实的是
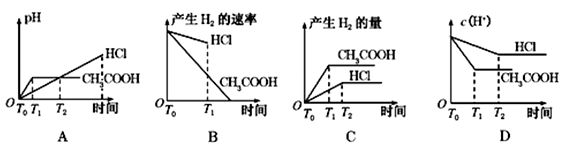
难度: 中等查看答案及解析
-
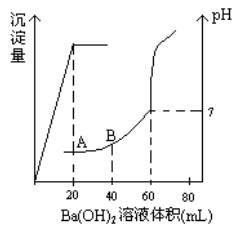
常温下,向0.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
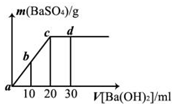
A.溶液的pH:a<b<c<d
B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性
D.c、d溶液呈碱性
难度: 中等查看答案及解析
-
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
难度: 中等查看答案及解析
-
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为
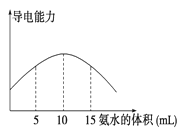
A.0.5% B.1.5% C.0.1% D.1%
难度: 中等查看答案及解析
-
常温下,0.1 mol·L-1某一元酸(HA)溶液中
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,水的电离平衡向正向移动
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
难度: 中等查看答案及解析
-
常温下,某一元酸HA溶液的pH为b,且有n(A-)∶n(HA)=1∶99。某一元强碱溶液的pH为a。若将1体积的此强碱溶液与100体积的HA溶液混合,恰好完全反应。则a与b之和为
A.18 B.17 C.16 D.15
难度: 中等查看答案及解析