-
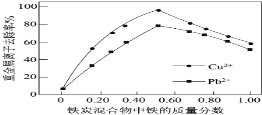
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的稳定性为H2T<H2R
B. 单质与稀盐酸反应的剧烈程度为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
常温下,用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是
A.水浴加热
B.加水稀释
C.滴加少许CuSO4溶液
D.改用铁粉并振荡
难度: 中等查看答案及解析
-
关于元素周期表的说法正确的
A.元素周期表有8个主族 B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期 D.短周期是指第一、二周期
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.甲烷分子的球棍模型:
 B.HClO的电子式为:
B.HClO的电子式为:C.S2-的结构示意图:
D.二氧化碳的结构式:C=O=C
难度: 简单查看答案及解析
-
下列说法正确的是
A.
原子核内含有4个质子 B.CH3CH2NO2与
互为同分异构体
C.正丁烷与异丁烷互为同系物 D.32S与33S是同种核素
难度: 简单查看答案及解析
-
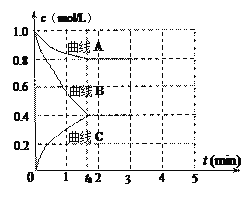
在2A + B⇌3C + 4D 反应中(各物质均为气体),表示该反应速率最快的是
A.v(A)= 0.5 mol·L-1·s-1 B.v(B)= 0.3 mol·L-1·s-1
C.v(C)= 0.8 mol·L-1·s-1 D.v(D)= 30 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和Si B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
难度: 中等查看答案及解析
-
根据如图提供的信息,下列所得结论不正确的是
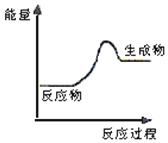
A.该反应是吸热反应
B.该反应中旧键断裂吸收的能量高于新键形成放出的能量
C.该反应可能是碳酸钙的分解反应
D.该反应一定需要加热才能发生
难度: 简单查看答案及解析
-
下列事实与氢键有关的是
A.水分解成氢气和氧气吸收热量
B.水结成冰体积膨胀,密度变小
C.水加热到很高的温度都难以分解
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 困难查看答案及解析
-
元素周期表是元素周期律的具体表现形式。下列说法正确的是
A.元素的原子结构决定了元素在周期表中的位置
B.同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱
C.最外层是二个电子的元素全部是金属元素
D.可在过渡元素中寻找半导体材料
难度: 简单查看答案及解析
-
如图是锌铜原电池的示意图。下列关于锌铜原电池说法正确的是( )
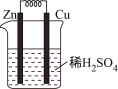
A. 锌作正极
B. 溶液中SO42-向铜电极方向移动
C. 电子由锌片通过导线流向铜
D. 负极发生的反应是:2H+ +2e-=H2↑
难度: 简单查看答案及解析
-
今有如下三个热化学方程式:
H2(g)+1/2 O2(g)=H2O(g);ΔH=a kJ·mol-1
H2(g)+1/2 O2(g)=H2O(l);ΔH=b kJ·mol-1
2H2(g)+O2(g)=2H2O(l);ΔH=c kJ·mol-1
关于它们的下列表述不正确的是
A.它们都是放热反应 B.a 和b的绝对值可以相等
C.a、b和c均为负值 D.2b = c
难度: 简单查看答案及解析
-
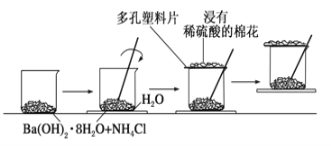
下图所示的实验操作,不能达到相应目的的是( )
A. 干燥氯气
B. 检验碳酸钾中的钾离子
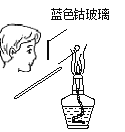 C. 验证氨气极易溶于水
C. 验证氨气极易溶于水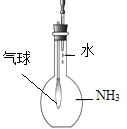 D. 实验室制氨气
D. 实验室制氨气
难度: 中等查看答案及解析
-
可逆反应
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成
的同时生成
②单位时间内生成
的同时生成
③用
表示的反应速率之比为
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 简单查看答案及解析
-
热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。
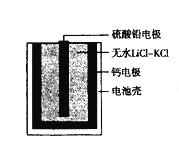
下列有关说法正确的是
A.正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
难度: 简单查看答案及解析
-
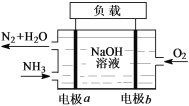
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
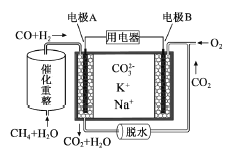
A.反应
,每消耗1mol CH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析