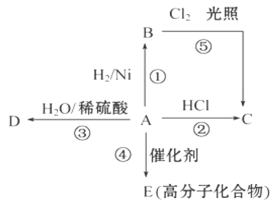
-
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
A.v(NH3)=0.2 mol/(L·s) B.v(O2)=1.4 mol/(L·min)
C.v(H2O)=0.25 mol/(L·s) D.v(NO)=9 mol/(L·min)
难度: 简单查看答案及解析
-
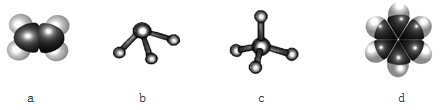
下列说法正确的是( )
A.CHCl3只有一种结构,说明甲烷是以碳原子为中心的正四面体结构
B.1mol甲烷生成CCl4最多消耗2mol氯气
C.标准状况下,11.2LCCl4中含有C—Cl键的数目为2NA
D.在点燃甲烷气体之前必须检验其纯度
难度: 简单查看答案及解析
-
二氧化氯(ClO2)是世界卫生组织(WHO)公认的新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用,研究表明,ClO2在浓度低于100mg·L−1时不会对人体产生任何的影响。在“新冠”疫情防控中ClO2也被广泛的用于公共场所的消杀。下列关于ClO2的说法正确的是
A.ClO2能用于消毒是因为它是氯的最高价氧化物
B.在进行消毒作业时使用的ClO2溶液浓度越大越好
C.ClO2杀菌力强,是一种比“84”性能更优越的消毒剂
D.ClO2可与NaOH在一条件下发生反应,产物只有NaClO3和H2O
难度: 简单查看答案及解析
-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol·L-1和2mol·L-1,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(假设反应中HNO3的还原产物全部为NO)
A.224mL B.448mL C.672mL D.896mL
难度: 中等查看答案及解析
-
下列化学家与其所作的突出贡献不匹配的是
A
B
C
D

舍勒

凯库勒

阿伏伽德罗

门捷列夫
发现了氯气
提出了苯的环式结构
最早提出分子的概念
提出化学元素的概念
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列化学用语使用正确的是
A.次氯酸的结构式:H–Cl–O B.氮气的电子式:
C.甲烷分子的比例模型为
D.乙烯的结构简式:CH2CH2
难度: 简单查看答案及解析
-
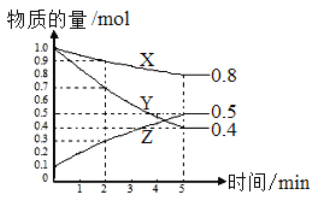
下列对于可逆反应2M(g)+N(g)
2P(g)达到平衡时的说法正确的是
A.反应混合物中各组分的浓度不再改变 B.反应已经停止
C.M、N全部变成了P D.速率之比为v(M)∶v(N)=1∶2
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性,其结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”,分子的说法正确的是
A.“钴酞菁”分子在水中形成的分散系能产生丁达尔效应
B.“钴酞菁”分子既能透过滤纸,又能透过半透膜
C.“钴酞菁”分子在水中形成的分散系属于悬浊液
D.“钴酞菁”分子直径比Na+直径小
难度: 简单查看答案及解析
-
不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
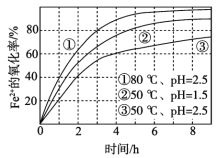
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
难度: 中等查看答案及解析
-
某铁—空气电池放电时,其原理如图所示。电池总反应为2Fe+O2+2H2O=2Fe(OH)2。下列说法正确的是( )
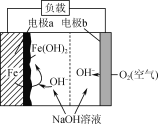
A.a极质量不变
B.b极为电池负极
C.电子从a电极经负载流向b电极
D.该装置将电能转变为化学能
难度: 简单查看答案及解析
-
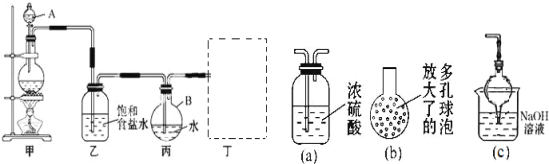
实验室从海带中提取碘的部分流程如图所示:

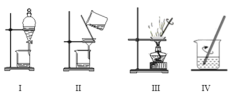
下列说法正确的是
A.完成步骤①需要装置III
B.完成步骤③需要装置I
C.完成步骤⑤需要装置II
D.完成步骤②和④需要装置IV
难度: 中等查看答案及解析
-
门捷列夫在对前人发现的元素进行研究进而发现了元素周期表,并用它科学地预测了铝的下方有一种与铝类似的“类铝”元素。1875年法国化学家布瓦德朗发现了这种元素,命名为“镓(Ga)”,它的性质和门捷列夫的预测相吻合。镓与铝是同主族元素,下列叙述不正确的是
A.镓的金属性比铝的强 B.镓的原子半径比铝的小
C.镓原子的最外层有3个电子 D.氮化镓的化学式是GaN
难度: 简单查看答案及解析
-
分子式为C4H9Cl的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)将A、C用导线相连后放入稀H2SO4中,C的表面有气泡产生;(2)将B放入D的硝酸盐中,B的表面析出单质D;(3)将C、E放入冷浓硫酸中,均无明显现象,由此可以推断五种金属A、B、C、D、E依次可能为
A.Fe、Cu、Al、Ag、Mg B.Mg、Cu、Al、Ag、Fe
C.Al、Cu、Mg、Ag、Fe D.Mg、Ag、Al、Cu、Fe
难度: 中等查看答案及解析
-
下列解释实验事实的离子方程式正确的是
A.向铜粉中滴加稀HNO3溶液,产生气体:Cu+2H+===Cu2++H2↑
B.向FeCl2溶液中通入氯气,溶液变为黄色:Fe2++Cl2===Fe3++2Cl-
C.向CuSO4溶液中滴加氨水,生成沉淀:Cu2++2OH-===Cu(OH)2↓
D.向FeCl3溶液滴加几滴KSCN,溶液变红色:Fe3++3SCN-===Fe(SCN)3
难度: 简单查看答案及解析
-
下列有关Na2O2的叙述正确的是
A.可做漂白剂 B.阳离子与阴离子的个数比为1:1
C.属于碱性氧化物 D.与水反应每生成1molO2,转移NA个e-
难度: 简单查看答案及解析