-
不能用元素周期律解释的性质是
A. 非金属性:Cl>Br B. 热稳定性:Na2CO3>NaHCO3
C. 酸性:HNO3>H2CO3 D. 碱性:NaOH>Mg(OH)2
难度: 中等查看答案及解析
-
下列各项中,完成空气质量报告时不需要监测的是
A. 二氧化碳的浓度 B. 二氧化硫的浓度
C. 可吸入颗粒物的浓度 D. 氮氧化物的浓度
难度: 简单查看答案及解析
-
化学与生活密切相关,下列应用中利用了物质氧化性的是
A.漂白粉用于生活用水的消毒 B.氢氧化铝用于中和过多胃酸
C.食醋用于除水垢 D.氢氟酸用于刻蚀玻璃
难度: 中等查看答案及解析
-
每年春季是疾病、流行性传染病多发的季节。几年前的SARS至今让人心悸。最新的研究表明:一氧化氮吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述不正确的是 ( )
A.一氧化氮是一种无色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮不溶于水,能用排水法收集
难度: 简单查看答案及解析
-
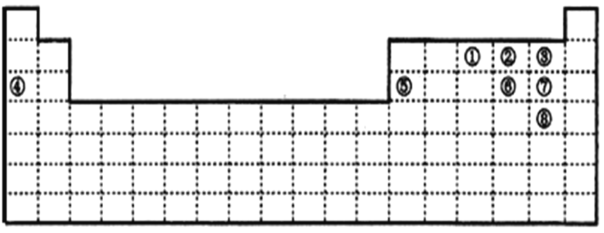
以下关于元素周期表结构的叙述正确的是
A.元素周期表有7个主族,8个副族
B.元素周期表有4个长周期、3个短周期
C.第ⅢA族位于元素周期表的第3列(从左往右)
D.0族位于元素周期表的第16列(从左往右)
难度: 简单查看答案及解析
-
下列有关硫的性质的叙述正确的是
A.淡黄色晶体,不溶于水易溶于酒精
B.质脆易粉碎,不溶于二硫化碳,加热易熔化
C.既有氧化性又有还原性,硫与铁粉和铜粉分别反应,都可生成二价金属硫化物
D.粘有硫的试管可用CS2或热的NaOH溶液清洗
难度: 中等查看答案及解析
-
下列有关氮气的叙述中错误的是( )
A. 氮气可作贮存水果、粮食的保护气
B. 氮的非金属性比磷强,所以氮气的化学性质比磷活泼
C. 在雷雨天,空气中的N2和O2反应生成NO
D. 氮气既可作氧化剂,又可作还原剂
难度: 简单查看答案及解析
-
将等体积混合的NO和NO2气体充满试管后倒立在水槽中,再通入一定量的氧气,溶液充满整个试管,则原混合气体与氧气的体积比是( )
A.2∶3 B.3∶2 C.3∶5 D.2∶1
难度: 中等查看答案及解析
-
有关氨气的实验较多,对这些实验的实验原理的分析中,正确的是
A.氨气极易液化的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3•H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
D.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
难度: 中等查看答案及解析
-
下列有关氨气的制备、干燥、收集和尾气处理错误的是
A.
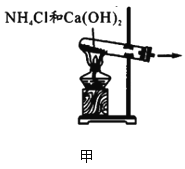 图甲:实验室制氨气 B.
图甲:实验室制氨气 B.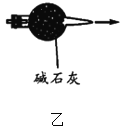 图乙:干燥氨气
图乙:干燥氨气C.
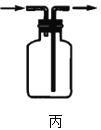 图丙:收集氨气 D.
图丙:收集氨气 D.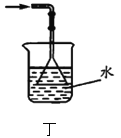 图丁:实验室制氨气的尾气处理
图丁:实验室制氨气的尾气处理难度: 中等查看答案及解析
-
中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是
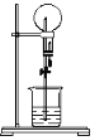
A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
D.HCl、NH3和SO2均能用该装置做喷泉实验
难度: 中等查看答案及解析
-
下列关于铵盐的叙述中正确的是( )
①所有铵盐中,氮元素化合价都是-3价;②所有铵盐都易溶于水
③铵态氮肥不宜与碱性肥料混合使用;④铵盐都是由离子构成的化合物
⑤铵盐都能与碱反应,不能与酸反应;⑥铵盐受热分解一定都会产生氨气
A.①③④ B.②③④ C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
在C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O中,浓硫酸体现出的性质是( )
A.酸性 B.吸水性 C.脱水性 D.强氧化性
难度: 中等查看答案及解析
-
将2.56 g Cu和一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.0.13 mol B.1 mol C.1.05 mol D.0.05 mol
难度: 中等查看答案及解析
-
下列关于元素周期表的说法中正确的是
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C.催化剂一般在金属与非金属的分界线处寻找
D.过渡元素全部是金属元素
难度: 简单查看答案及解析
-
下列关于化学键的说法中不正确的是( )
A.化学键可以使离子相结合,也可以使原子相结合
B.化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成
C.非金属元素的原子之间只能形成共价键
D.化学键是一种作用力
难度: 简单查看答案及解析