-
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
难度: 中等查看答案及解析
-
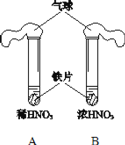
下列关于浓硫酸的叙述正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
难度: 简单查看答案及解析
-
下列各组物质的相互关系正确的是( )
A.同位素:H+、H2、2H、3H
B.同素异形体:C60、C70、C(石墨)
C.同分异构体:C3H8、C4H10
D.同系物:正丁烷、异丁烷
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:
B. N2的结构式:N=N
C. Na+的结构示意图:
D. H2O的电子式:
难度: 简单查看答案及解析
-
下列化学式只表示一种物质的是( )
A.C3H7Cl B.C3H8 C.C2H4Cl2 D.C
难度: 中等查看答案及解析
-
在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是( )
A.硫铁矿煅烧前要粉碎,因为大块硫铁矿不能燃烧
B.从沸腾炉出来的气体只有 SO2
C.SO2 氧化成 SO3,SO2 能全部转化为 SO3
D.SO3 用 98.3%的浓 H2SO4 吸收,目的是防止形成酸雾,以便使 SO3 吸收完全
难度: 简单查看答案及解析
-
下列各组晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.NaCl与HCl C.CO2与H2O D.CCl4与KCl
难度: 简单查看答案及解析
-
已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=
v(NH3) B.v(H2O)=
v(O2) C.v(H2O)=
v(NH3) D.v(NO)=
v(O2)
难度: 中等查看答案及解析
-
下列条件中,锌和硫酸开始反应时放出氢气的速率最大的是
选项
金属
酸溶液的浓度和体积
温度/℃
A
2.4 g锌片
3 mol·L-1硫酸50 mL
40
B
2.4 g锌粉
1 mol·L-1硫酸200 mL
30
C
2.4 g锌粉
3 mol·L-1硫酸50 mL
40
D
5.6 g锌片
3 mol·L-1硫酸100 mL
30
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
X
Y
Z
W
A. X的气态氢化物比Y稳定
B. W的最高价氧化物的水化物的酸性比Z强
C. Z的非金属性比Y强
D. X与Y形成的化合物都易溶于水
难度: 困难查看答案及解析
-
如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
难度: 中等查看答案及解析
-
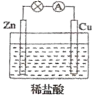
将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是
( )
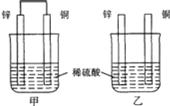
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙快
难度: 中等查看答案及解析
-
下列不能说明氯的非金属性比硫强的事实是:①HCl比H2S稳定;②HClO氧化性比H2SO4强;③HClO4酸性比H2SO4强;④Cl2能与H2S反应生成S; ⑤氯原子最外层有7个电子,硫原子最外层有6个电子;⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;⑦HCl酸性比H2S 强
A.②⑤⑦ B.①②⑦ C.②④⑥ D.①③⑤
难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法,下列推理正确的是( )
A.工业上用电解熔融 MgCl2 的方法制取金属镁,故也可用电解熔融AlCl3 的方法制取金属铝
B.SO2 与H2O2 反应生成H2SO4,推测 SO2 与Na2O2 反应生成Na2SO4
C.SO2 和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
D.Fe 常温下在浓硝酸中钝化,推测 Cu 常温下在浓硝酸中钝化
难度: 中等查看答案及解析
-
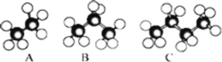
下列说法正确的是( )
A.分子式为C2H6 和分子式为C5H12 的烷烃的一氯代物的数目可能相同
B.烷烃的通式为CnH2n+2,随 n 的增大,碳元素的质量分数逐渐减小
C.
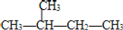 和
和 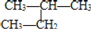 互为同分异构体
互为同分异构体D.丙烷的比例模型为
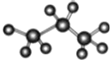
难度: 中等查看答案及解析