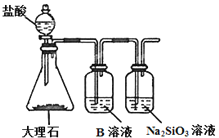
-
下列说法中,错误的是
A. 稀有气体元素原子的最外层电子数均为8个
B. 元素周期表中有7个主族、7个副族
C. 碳元素位于第2周期IVA族
D. 氢分子中的化学键是共价键
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A. 氢氧化钡晶体与氯化铵晶体的反应 B. 甲烷在空气中燃烧
C. 盐酸与氢氧化钠溶液反应 D. 金属钠与水反应
难度: 简单查看答案及解析
-
下列过程放出热量的是
A. 冰的融化 B. 水的分解 C. 浓硫酸稀释 D. 硝酸铵溶于水
难度: 简单查看答案及解析
-
已知0.5mol甲烷完全燃烧后生成二氧化碳和液态水时,可放出445kJ的热量,下列热化学方程式书写正确的是
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-445 kJ·mol-1
C. CH4+2O2=CO2+2H2O ΔH=+445 kJ·mol-1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
难度: 简单查看答案及解析
-
镓(Ga)是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属IIIA族,熔点为29.78℃,沸点高达2403℃。由此判断下列有关镓的性质及其用途的叙述错误的是
A. 镓原子的最外层电子数为3
B. 镓是制造高温温度计的上佳材料
C. Al(OH)3和Ga(OH)3均是两性氢氧化物
D. 常温常压下镓完全能够熔化在手心里
难度: 简单查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X+是一个裸露的质子,X和Z处于同一主族,Y、Z的最外层电子数之和与Q的最外层电子数相等,W的最内层电子数和最外层电子数之和等于次外层电子数。下列说法不正确的是
A. Y分别与X、Z、W形成的化合物都不止一种
B. 原子半径:rQ>rW>rZ>rY>rX
C. 化合物XQ和ZQ中化学键的类型不同
D. W的一种氧化物是形成酸雨的主要成分
难度: 简单查看答案及解析
-
在下列有关晶体的叙述中错误的是 ( )
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
难度: 简单查看答案及解析
-
已知M2+有2个电子层,则M在元素周期表中的位置是
A.第2周期0族 B.第2周期Ⅷ族 C.第2周期ⅡA族 D.第3周期ⅡA族
难度: 简单查看答案及解析
-
下列变化中,吸收的热量用于克服分子间作用力的是
A.加热金属铝使之熔化 B.液氨受热蒸发
C.加热碘化氢气体使之分解 D.加热硅晶体使之熔化
难度: 中等查看答案及解析
-
与主族元素在元素周期表中所处的位置有关的是
A.元素的相对原子质量 B.原子的核内中子数
C.原子的次外层电子数 D.原子的电子层数和最外层电子数
难度: 简单查看答案及解析
-
科学史上每一次重大的发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于
A.揭示了燃烧的本质 B.开发了合成氨的生产工艺
C.提出了元素周期律 D.提取了治疟药物青蒿素
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.CH4分子的球棍模型:
 B.硫原子的结构示意图:
B.硫原子的结构示意图:C.氮气的电子式:
D.水分子的结构式:
难度: 中等查看答案及解析
-
澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同素异形体 B.同分异构体 C.同一种物质 D.同位素
难度: 中等查看答案及解析
-
下列说法中正确的是
A.氯化氢溶于水能电离出H+ 、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧是同分异构体
D.有机化合物CH3—CH2—NO2和H2N—CH2—COOH是同分异构体
难度: 简单查看答案及解析
-
硼的最高价含氧酸的化学式不可能是
A.H2BO4 B.H3BO3 C.HBO2 D.H2B4O7
难度: 中等查看答案及解析
-
X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.原子半径:H < Al < Mg < Na
B.热稳定性:HCl > H2S > PH3 > AsH3
C.N、O、F元素的非金属性依次减弱
D.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
难度: 中等查看答案及解析
-
下列关于反应速率的说法正确的是
A.对于任意化学反应,其他条件不变时,增大压强都一定能加快化学反应速率
B.相同条件下,大小相等的铝片与浓硫酸反应比与稀硫酸反应放出氢气的速率大
C.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
D.反应速率用于衡量化学反应进行的快慢,决定反应速率的主要因素是反应物的性质
难度: 中等查看答案及解析
-
已知反应A(g) + 3B(g)
2C(g) + D(g),若在某时间段内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则在此时间段内以C的浓度变化表示的化学反应速率为
A. 0.5 mol·L-1·min-1 B. 2 mol·L-1·min-1
C. 3 mol·L-1·min-1 D. 1 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列物质中,既有离子键,又有共价键的是
A.KCl B.NH4Cl C.H2O D.CH4
难度: 中等查看答案及解析
-
下列有关化学能与热能的说法正确的是
A.铝热反应属于吸热反应
B.H2→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.若某反应生成物的总能量大于反应物的总能量,则该反应为放热反应
难度: 中等查看答案及解析
-
如图是反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是
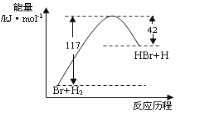
A. 正反应为吸热反应
B. 该反应的逆反应是吸热过程
C. 反应物具有的总能量大于生成物具有的总能量
D. 从图中可以看出,HBr的能量一定高于H2的能量
难度: 简单查看答案及解析
-
根据下列各组元素的原子序数,可组成化学式为AB2型共价化合物是
A.9和1 B.11和8 C.12和17 D.6和8
难度: 中等查看答案及解析