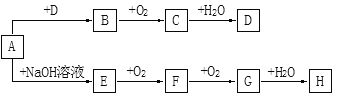-
下列各组物质中化学键的类型完全相同的是( )
A.NaCl MgCl2 Na2O
B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4
D.NH4Cl H2O CO2
难度: 中等查看答案及解析
-
一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
难度: 中等查看答案及解析
-
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
难度: 中等查看答案及解析
-
关于二氧化硫和二氧化氮叙述正确的是( )
A.两种气体都是有毒的气体,且都可用水吸收以消除对空气的污染
B.两种气体都具有强氧化性,因此都能够使品红溶液褪色
C.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸
D.两种气体溶于水都可以与水反应,且只生成相应的酸,大气中的 NO2 和 SO2 可以形成酸雨
难度: 中等查看答案及解析
-
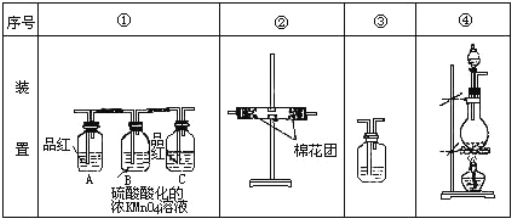
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中说法不正确的是( )
A.
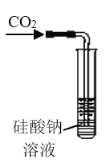 可用来证明碳的非金属性比硅强
可用来证明碳的非金属性比硅强B.
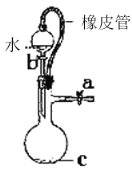 橡皮管的作用是能使水顺利流下
橡皮管的作用是能使水顺利流下C.
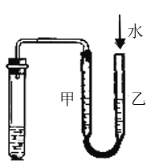 用图示的方法不能检查此装置的气密性
用图示的方法不能检查此装置的气密性D.
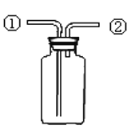 先从①口进气集满CO2,再从②口进气,可收集NO
先从①口进气集满CO2,再从②口进气,可收集NO难度: 中等查看答案及解析
-
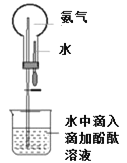
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
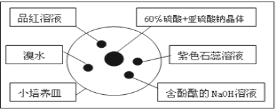
A.紫色石蕊溶液先变红后褪色 B.品红溶液褪色
C.溴水橙色褪去 D.含酚酞的NaOH溶液红色变浅
难度: 中等查看答案及解析
-
某兴趣小组探究 SO2 气体还原 Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )
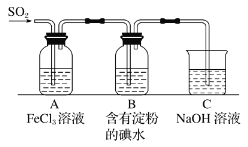
A.为了验证 A 中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
B.为了验证 A 中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
C.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
D.装置C的作用是吸收SO2尾气,防止污染空气
难度: 中等查看答案及解析
-
下列属于固氮反应的是( )
A.2NO+O2→2NO2 B.3NO2+H2O→2HNO3+NO
C.NH3+HCl→NH4Cl D.N2+3Mg→Mg3N2
难度: 简单查看答案及解析
-
硫跟浓硫酸共热产生的气体X和银跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
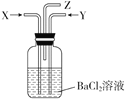
A.洗气瓶中产生的沉淀是BaCO3
B.洗气瓶中产生的沉淀是BaSO4
C.洗气瓶中产生的沉淀是BaSO3
D.洗气瓶中不会产生任何沉淀
难度: 中等查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件己略去) ( )
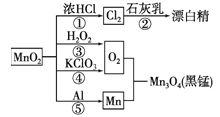
A.只有反应①②④均属于氧化还原反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
难度: 困难查看答案及解析
-
FeS、FeS2在酸性条件下都能与重铬酸钾(K2Cr2O7)溶液反应,还原产物为Cr3+,氧化产物都是Fe3+、SO42-。等物质的量FeS、FeS2完全反应时,消耗氧化剂的物质的量之比为
A.5:3 B.9:17 C.3:5 D.3:4
难度: 困难查看答案及解析
-
有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是( )
A.29 m2/m1 B.29 m3/m1
C.29(m2-m1)/(m3-m1) D.29(m3-m1)/(m2-m1)
难度: 困难查看答案及解析
-
已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质质量分数将
A.无法确定 B.等于40%
C.小于40% D.大于40%
难度: 困难查看答案及解析
-
下列化学用语书写正确的是( )
A.氯原子的结构示意图:
B.氨分子的电子式为:
C.氯化镁的电子式:
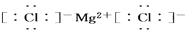
D.HCl的形成过程可表示为:
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是( )
A.X、Y 元素的金属性:X<Y
B.一定条件下,W 单质可以将 Z 单质从其氢化物中置换出来
C.一定条件下,Z 单质与 W 的常见单质直接生成 ZW2
D.Y 的最高价氧化物对应的水化物能溶于稀氨水
难度: 中等查看答案及解析