-
空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液,将SO2和NO2按一定比例混合,以N2或空气为载体通入反应室,相同时间后,检测吸收液中SO42-的含量,数据如下:
反应室
载气
吸收液
SO42-含量
数据分析
①
N2
蒸馏水
a
ⅰ. b≈d>a≈c
ⅱ.若起始不通入NO2,则最终检测不到SO42-
②
3%氨水
b
③
空气
蒸馏水
c
④
3%氨水
d
下列说法不正确的是
A.控制SO2和氮氧化物的排放是治理雾霾的有效措施
B.反应室①中可能发生反应:SO2 + 2NO2 + 2H2O=H2SO4 + 2HNO2
C.本研究表明:硫酸盐的形成主要与空气中O2有关
D.农业生产中大量使用铵态氮肥可能会加重雾霾的形成
难度: 中等查看答案及解析
-
化学科学对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是
A.某些金属元素的焰色反应、海水提溴、煤的气化、石油的裂化都是化学变化的过程
B.光化学烟雾、酸雨和温室效应等环境问题是氮氧化物大量排放造成
C.油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
D.白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被氧化
难度: 简单查看答案及解析
-
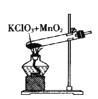
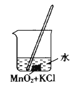
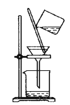
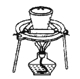
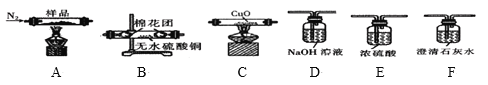
用KClO3和MnO2制备O2,并回收MnO2和KCl。下列实验操作正确的是( )
A.O2制备装置
B.固体混合物溶解
C.过滤回收MnO2
D.蒸发制KCl
难度: 简单查看答案及解析
-
化合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法不正确的是( )
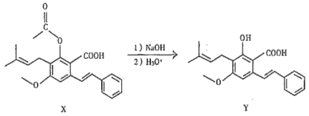
A.1molX最多能与3molNaOH反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能使酸性高锰酸钾溶液褪色
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等
难度: 中等查看答案及解析
-
雌黄(As2S3)在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( )
A.砷酸的分子式为H2AsO4
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为10:1
D.该反应中每析出4.8g硫磺转移1mol电子
难度: 中等查看答案及解析
-
乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
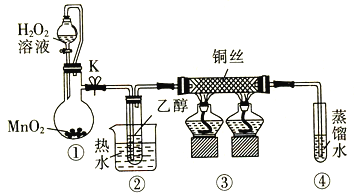
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
难度: 中等查看答案及解析
-
前四周期元素X、Y、Z、W、T的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中电负性最小,二元化合物E中元素Y和W的质量比为23:16;同周期元素简单离子中,元素Z形成的离子半径最小;T元素的价电子排布式为3d104s1。下列说法正确的是( )
A.简单离子的半径Y>Z>W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和T的单质混合加热可得化合物T2W
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
选项
实验目的
实验过程
A
检验久置的Na2SO3粉末是否变质
取样配成溶液,加入盐酸酸化,再加氯化钡溶液,观察到有白色沉淀产生
B
制备纯净的FeCl2
向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液
C
制备银氨溶液
向5mL0.1mol•L-1 AgNO3 溶液中加入1mL0.1mol•L-1 NH3•H2O
D
探究浓度对反应速率的影响
向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在Zn/ZSM-5的催化作用下,甲烷与二氧化碳可以直接合成乙酸,其反应方程式为CH4(g)+CO2(g)→CH3COOH(g),该反应过程与能量的变化关系如图所示。下列说法错误的是( )
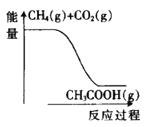
A.CO2的电子式:
B.乙酸的球棍模型:
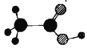
C.该反应为吸热反应
D.该反应为化合反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.17g由H2S与PH3组成的混合气体中含有的质子数为9NA
B.90g果糖(C6H12O6,分子中无环状结构和碳碳双键)中含有的非极性键数目为3NA
C.1mol由乙醇与二甲醚(CH3-O-CH3)组成的混合物中含有的羟基数目为NA
D.已知
Ra→X+
He,则0.5molX中含有的中子数为34NA
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
A.①②③ B.②③④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)
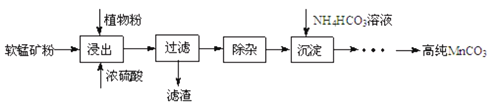
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.浸出时加入植物粉的作用是作为还原剂
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
难度: 中等查看答案及解析
-
常温下,用0.1000
NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确的是( )
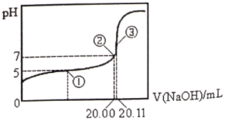
A. 点①②③三处溶液中水的电离程度依次增大
B. 该温度时CH3COOH的电离平衡常数约为
C. 点①③处溶液中均有c(H+)=c(CH3COOH)+c(OH-)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 中等查看答案及解析
 ,As原子的杂化类型为__。
,As原子的杂化类型为__。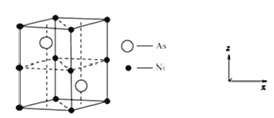
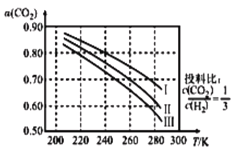

 溶液
溶液 得固体bg
得固体bg 测得气体体积VmL(标况)
测得气体体积VmL(标况) 250mL溶液
250mL溶液 三次平均消耗0.1mol•L-1酸性KMnO4溶液VbmL
三次平均消耗0.1mol•L-1酸性KMnO4溶液VbmL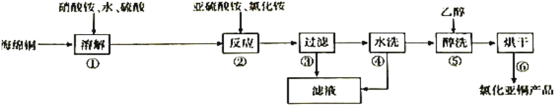
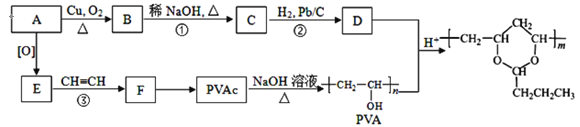
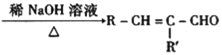 +H2O
+H2O (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子) 。____。
。____。