-
在一密闭容器中有如下反应:aX(g)+bY(g)
nW(g),某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
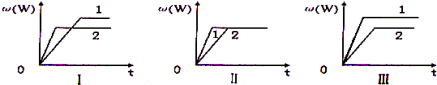
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图I可能是不同压强对反应的影响,且p2>p1,a+b>n
B.图I可能是不同温度对反应的影响,且T2>T1,△H>0
C.图II可能是不同压强对反应的影响,且p1>p2,n=a+b
D.图Ⅲ可能是不同温度对反应影响,且T1>T2,△H<0
难度: 困难查看答案及解析
-
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A.0-t1时,正极的电极反应式为:2H+ + NO3- - e-=NO2 + H2O
B.0-t1时,溶液中的H+ 向Cu电极移动
C.t1时,负极的电极反应式为:Cu–2e-= Cu2+
D.t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
难度: 困难查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、A1 3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

己知:3NO3-+ 8Al+5OH-+ 2H2O
3NH3+8A1O2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
C.试样中可能存在Na+、Cl-
D.试样中一定不含A13+
难度: 极难查看答案及解析
-
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有
A.9种 B.12种 C.15种 D.16种
难度: 困难查看答案及解析
-
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2 (g)-
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1 L的恒容密闭容器中充入l mol CO2和3 mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图F6-2所示,且平衡时体系压强为p1。下列叙述中不正确的是 ( )
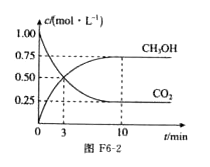
A.0~3 min内,v(CO2) 正=v(CH3OH)正
B.在T1℃时,若起始时向容器中充人2 mol CO2和6 mol H2,测得平衡时容器内压强为p2,则p2<2p1
C.其他条件不变,若向平衡后的体系中充人1 mol氦气,体系压强增大,平衡将向正反应方向移动
D.T2℃时,上述反应平衡常数为4.2,则T2>T1
难度: 极难查看答案及解析
-
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是 ( )
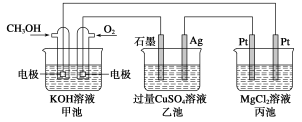
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
难度: 极难查看答案及解析
-
向含有0.2molFeI2的溶液中加入a molBr2。下列叙述不正确的是( )
A.当a=0.1时,发生的反应为2I-+Br2=I2+2Br-
B.当a=0.25时,发生的反应为2Fe2++4I-+3Br2=2Fe3++2I2+6Br-
C.当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1
D.当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
难度: 中等查看答案及解析
-
组成和结构可用
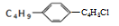 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )A.16种 B.28种 C.48种 D.60种
难度: 极难查看答案及解析
-
一定温度下的可逆反应:A(s)+2B(g)
2C(g)+D(g)△H<0.现将1mol A和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )

A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
难度: 极难查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
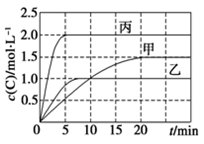
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物起始量
1.5 mol A
0.5 mol B
1.5 mol A
0.5 mol B
6.0 mol A
2.0 mol B
下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
难度: 极难查看答案及解析
-
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2.则该有机物的同分异构体有( )种(不考虑立体异构)
A.10 B.11 C.12 D.13
难度: 极难查看答案及解析
-
分子式 C4H8O2和C5H10O2的两种一元羧酸与乙二醇(HOCH2CH2OH)发生酯化反应,生成分子式为C11H20O4的酯最多有(不考虑立体异构)
A .6种 B.8种 C.10种 D .12种
难度: 困难查看答案及解析
-
如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用下图乙所示方法。已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、SO42-、PO43-等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水。

图甲
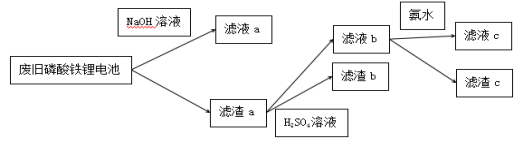
图乙
下列说法不正确的是( )
A.向滤液a中加入适量H2SO4溶液,可以得到白色沉淀
B.滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色
C.要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶
D.图中的氨水可以用适量NaOH溶液代替
难度: 困难查看答案及解析
-
“当好东道主,喜迎G20”,目前杭州为迎接即将到来的G20峰会,大量引进新能源公交车,如图所示即为一辆正在充电的电动公交车。

已知钒电池是一种常用于纯电动公交车的电池,其原理是利用钒的不同价态之间的转化,例如某种电池的充电原理可表示为2H++V2++VO2+=2V3++H2O,则下列说法不正确的是
A.阴极反应可表示为2H++VO2++e-=V3++H2O
B.阳极反应可表示为V2+-e-=V3+
C.若阴极电解液体积为1L,电解前pH=1,当测得V3+的物质的量浓度为0.045mol/L时,pH变为2(不考虑反应过程中体积变化)
D.放电过程种负极反应可表示为V3++2OH--e-=VO2++H2O
难度: 困难查看答案及解析
-
胡妥油(D)用作香料的原料,它可由A合成得到:
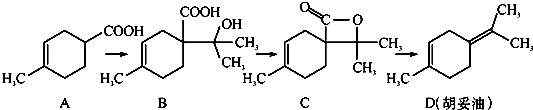
A.从B到C的反应是消去反应
B.D分子中所有碳原子一定共面
C.等物质的量的B分别与足量的Na、NaHCO3反应,产生的气体的物质的量前者大于后者
D.若A是由2-甲基-1,3-丁二烯和丙烯酸(CH2=CHCOOH)加热得到的,则该反应的类型属于加成反应
难度: 极难查看答案及解析
-
某溶液中含如下离子组中的几种K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成进行了如下实验:
Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入BaCl2溶液有白色沉淀生成,再滴加KSCN溶液,上层清液变红,第二支试管加入CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是
A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I-
B.原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42-
C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生
D.为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
难度: 困难查看答案及解析

