-
下列说法正确的是
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 环己烷与苯可用酸性KMnO4溶液鉴别
D. 水可以用来分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
下列各项叙述中,正确的是( )
A. Si、P、S的第一电离能随原子序数的增大而增大
B. 价电子排布为3d64s2的元素位于第四周期第ⅧB族,是d区元素
C. 2p和3p轨道形状均为哑铃形,能量不相等
D. 氮原子的最外层电子排布图:
难度: 中等查看答案及解析
-
下列关于元素第一电离能的说法不正确的是( )
A. 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B. 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大
C. 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D. 对于同一元素而言,原子的逐级电离能越来越大
难度: 中等查看答案及解析
-
某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C14H10O5 B. C14H16O4 C. C14H22O5 D. C14H18O5
难度: 中等查看答案及解析
-
元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为( )nm
A. 404.4 B. 553.5 C. 589.2 D. 670.8
难度: 简单查看答案及解析
-
下列变化或数据与氢键无关的是 ( )
A. 氟化氢的沸点比氯化氢的沸点高
B. 氨分子与水分子形成一水合氨
C. 乙醇能跟水以任意比混溶
D. SbH3的沸点比PH3高
难度: 中等查看答案及解析
-
关于SiO2晶体的叙述中,正确的是
A. 通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B. 60 g SiO2晶体中,含有2NA个Si—O键
C. 晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D. 因为硅和碳属于同一主族,所以SiO2晶体与CO2晶体类型相同
难度: 中等查看答案及解析
-
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫磺和碘
A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤
难度: 简单查看答案及解析
-
根据所学相关知识,分析正确的是( )
A. 氨气分子的空间构型为三角锥形,N2H4的氮原子杂化方式为SP2
B. 金属晶体铜配位数为12,空间利用率为68%
C. 石墨晶体中,既有共价键,又有金属键,还有范德华力,是一种混合晶体
D. 在氯化钠晶体中,氯离子的配位数为8
难度: 困难查看答案及解析
-
下列化合物中同分异构体数目最少的是 ( )
A. 戊烷 B. 戊醇 C. 戊烯 D. 丁烷
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体 B. 二氯代物超过两种
C. 所有碳原子均处同一平面 D. 生成1 molC5H12至少需要2 molH2
难度: 中等查看答案及解析
-
下列有机反应属于同一反应类型的是
A. 甲烷制一氯甲烷、苯制硝基苯
B. 苯制溴苯、乙烯制乙醇
C. 乙醇制乙醛、乙醇和乙酸制乙酸乙酯
D. 苯生成环己烷、多糖的水解
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. 乙醇可以被氧化为乙酸,二者都能发生酯化反应
B. 乙醇易燃烧,污染小,只能在实验室中作燃料
C. 常在燃料乙醇中添加少量煤油用于区分食用乙醇和燃料乙醇,因为煤油具有特殊气味
D. 除去乙醇中少量乙酸:加入足量生石灰蒸馏。
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A.
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C.
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
难度: 简单查看答案及解析
-
下列试验中,所选装置不合理的是
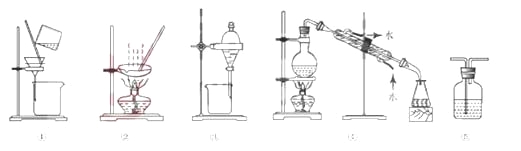
A. 分离Na2CO3溶液和CH3COOC2H5,选④
B. 用CC14提取碘水中的碘,选③
C. 用FeC12,溶液吸收C12,选⑤
D. 粗盐提纯,选①和②
难度: 中等查看答案及解析
-
下列制作铅笔的材料与相应工业不对应的是
A.橡皮擦——橡胶工业 B.铝合金片——冶金工业
C.铝笔芯——电镀工业 D.铅笔漆——涂料工业
难度: 简单查看答案及解析
-
科学家发现铂的两种化合物a和b,它们的化学式都为PtCl2(NH3)2. 。实验测得a和 b具有不同的特性:a具有抗癌作用,而b没有。则下列关于ab的叙述正确的是( )
A. a和b属于同一种物质 B. a和b 互为同分异构体
C. a和b的空间构型一定是四面体型 D. a在实际中有用,b没有用
难度: 困难查看答案及解析