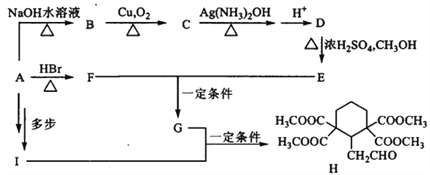
-
《天工开物》中记载: 人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于( )
A. 糖类、蛋白质 B. 糖类、油脂 C. 蛋白质、纤维素 D. 纤维素、油脂
难度: 简单查看答案及解析
-
下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
向待测溶液中先滴加几滴氯水,然后滴加KSCN 溶液
溶液变红
待测溶液中含有Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O 能大
量共存
D
向10mL0.1mol· L-1Na2S溶液中滴入2mL0.1 mol· L-1 ZnSO4溶液,再加入0.1 mol· L-1CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. H2SO4 是 挥 发性 二 元 强 酸
B. Al2O3是金属氧化物、也是碱性氧化物
C. 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L 二氯甲烷的分子数约为NA个
B. 106gNa2CO3固体中含有NA个CO32-
C. 1molFe 与过量的稀HNO3反应,转移2NA个电子
D. 1.0L的0.1 mol· L-1Na2S溶液中含有的S2-离子数为0.1NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是K层电子数的3倍,W的单质为有色气体。常温下,Z和W形成化合物的水溶液的pH=7。下列说法正确的是( )
A. X 与W位于相同周期、不同主族元素
B. 简单离子半径: X<Z
C. 简单氢化物的沸点: X>Y>W
D. Z和W形成化合物的水溶液与Y 单质反应,能置换出W
难度: 中等查看答案及解析
-
1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton 反应。下列说法不正确的是( )
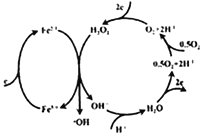
A. 羟基自由基(-OH) 的电子式为:
B. 右图所在的惰性电极应与外接电源的负极相连
C. Fenton反应: Fe2++H2O2==Fe3++OH-+-OH
D. 右图所在的惰性电极每消耗22.4LO2 (标准状况),理论上在外电电路中转移4mole-
难度: 中等查看答案及解析
-
通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,离子不存在。图为H3PO4 (图中用H3A 表示) 在加入强酸或强碱溶液后,平衡时溶液中各微粒浓度的对数值(lgc)-pH图。下列说法不正确的是( )
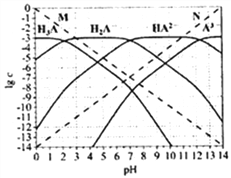
A. H3PO4 、H2PO4-、HPO42-、PO43-不能在同一溶液中大量共存
B. H3PO4电离平衡常数Ka2≈1×10-7
C. 图中虚线M、N 分别代表H+和OH-
D. pH=10时,溶液中存在关系:c(HPO42-) >c(OH-) >c(PO43-) >c(H2PO4-) >c(H3PO4)>c(H+)
难度: 困难查看答案及解析

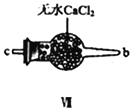
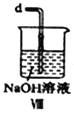
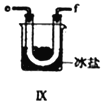

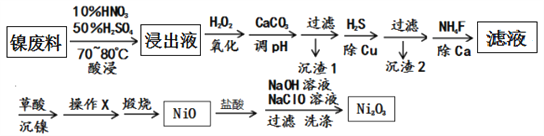

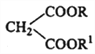 + R3Cl
+ R3Cl 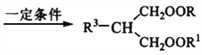 +HCl
+HCl