-
Ⅰ.下列物质中:①氯化钠 ②干冰 ③盐酸 ④铜 ⑤硫酸钡 ⑥蔗糖 ⑦I2 ⑧熔融的硝酸钾 ⑨食盐水
(1)能导电的是(填编号,下同)________;
(2)属于电解质的是________;
(3)属于非电解质的是________.
Ⅱ.100mL 1mol•L-1Al2(SO4)3溶液中含SO42-离子________个,含Al3+离子________mol.0.6mol O2与0.4mol O3质量之比为________,分子个数之比为________,原子个数之比________,它们在同温同压下的体积比是________.难度: 中等查看答案及解析
-
用18mol/L 的浓硫酸配制100mL 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④检漏、转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(用下列编号填空).
A.10ml B.25ml C.50ml D.100ml
(2)第③步实验的操是________.
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线________;改用________向容量瓶中滴加蒸馏水至________为止.塞紧瓶塞,倒转摇匀并装试剂瓶.
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在________.
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水________;
②所用过的烧杯、玻璃棒未洗涤________;
③加水超过刻度线后,用胶头滴管吸出多余的液体________.难度: 中等查看答案及解析
-
某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2-→O2.
(1)该反应中的还原剂是________.
(2)该反应中,发生还原反应的过程是________-→________.
(3)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目________.
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________.难度: 中等查看答案及解析
-
A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.现做以下实验:
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式分别为:
A________ B________ C________ D________
(2)写出实验步骤②中涉及到的所有反应的离子方程式:________.难度: 中等查看答案及解析
-
某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图).
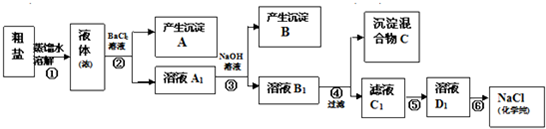
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④________,⑤________,⑥________;
(2)沉淀混合物C的化学成分有(用文字和化学式表示):________;
(3)写出第⑤步操作中可能发生反应的离子方程式:________;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:________;
(5)你认为该设计里哪些步骤调换后不影响实验结果:________;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:________.难度: 中等查看答案及解析
-
二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1.写出Se和浓HNO3的反应方程式________.
(2)已知:Se+2H2SO4(浓)2SO2↑+SeO2+2H2O;
2SO2+SeO2+2H2OSe+2SO42-+4H+;
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________.
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000mol•L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为________.难度: 中等查看答案及解析