-
光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是( )
A.铜 B.钢 C.石英 D.铁
难度: 简单查看答案及解析
-
下列实验操作中,所用仪器合理的是( )
A.用托盘天平称取25.20g氯化钠
B.用100mL量筒量取5.2mL盐酸
C.在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体
D.用100mL容量瓶配制450mL 0.1mol/L盐酸
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.工业上可用碳在高温下还原二氧化硅制取硅
B.漂白粉的主要成分是次氯酸钙
C.镁条能在二氧化碳气体中燃烧
D.将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,8gO2含有4NA个电子
B.1mol•L-1Na2SO4溶液中Na+个数为2 NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③NaAlO2溶液;④饱和Na2CO3溶液;⑤Ca(OH)2。最终溶液中有白色沉淀析出的是( )
A.①②③ B.②③④ C.②④⑤ D.①②④
难度: 中等查看答案及解析
-
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
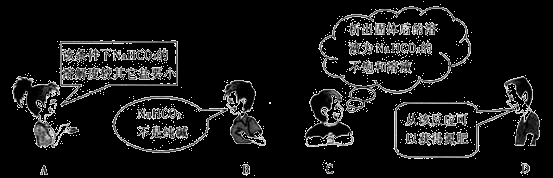
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.稀盐酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.水玻璃中通入过量二氧化碳气体:SiO32-+CO2+H2O=H2SiO3+CO32-
C.浓烧碱溶液中加入铝片:Al+OH-+H2O=AlO2-+H2↑
D.NaHSO4与足量Ba(OH)2溶液混合:H+ + SO42-+ Ba2++ OH- =BaSO4↓+H2O
难度: 困难查看答案及解析
-
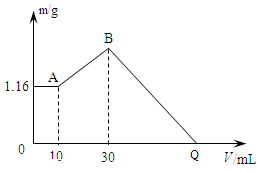
在某无色溶液中缓缓地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+ C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 中等查看答案及解析
-
下列各组中均为两瓶无标签的无色溶液,不许使用其它任何试剂(包括水),也能鉴别出来的是( )
①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2
A.①②③ B.②③④ C.①③④ D.①②④
难度: 中等查看答案及解析
-
已知反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是( )
A.HNO3是氧化剂,NO2是氧化产物
B.若2mol HNO3(浓)完全反应,则反应中共转移了NA个电子
C.还原剂与氧化剂的物质的量比是1 :4
D.氧化产物和还原产物的物质的量之比为2 :1
难度: 中等查看答案及解析
-
有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数( )
A.52.4% B.30% C.70% D.47.6%
难度: 困难查看答案及解析
-
下表中对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是()
陈述I
陈述II
判断
A
Fe3+具有氧化性
用KSCN溶液可以鉴别Fe3+
I对,II对,有
B
溶解度:CaCO3<Ca(HCO3)2
溶解度Na2CO3<NaHCO3
I对,II对,无
C
金属钠具有强氧化性
高压钠灯发出透雾性强的黄光
I对,II对,有
D
SiO2可与HF反应
氢氟酸不能保存在玻璃瓶中
I对,II对,有
难度: 困难查看答案及解析
-
向100mL0.25mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45g B.2.3g C.1.15g D.0.575g
难度: 困难查看答案及解析
-
在15g铁和氧化铁的混合物中,加入稀硫酸150mL,能放出H21.68L(标准状况)。同时铁和氧化铁均无剩余。向溶液中滴入KSCN溶液,未见颜色变化,为了中和过量的硫酸,而且使Fe2+完全转化成Fe(OH)2,共消耗3mol/L的NaOH溶液200mL,原硫酸溶液的物质的量浓度是( )
A.1.5mol/L B.2.5mol/L C.2mol/L D.3mol/L
难度: 困难查看答案及解析
-
使5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况下),这4.48L气体的质量为( )
A.8.2g B.8.8g C.6.4g D.6.2g
难度: 困难查看答案及解析
-
已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
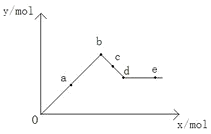
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
难度: 困难查看答案及解析