-
下列说法正确的是 ( )
A.某物质灼烧时焰色反应为黄色,则一定只含钠元素,不含其他元素
B.铝制品在生活中十分普遍,是因为铝不活泼
C.碳酸氢钠在医疗上可用于治疗胃酸过多
D.地壳中含量最多的金属是铁
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A. 钠燃烧产物为过氧化钠 B. 锂燃烧产物为氧化锂
C. Na2O和Na2O2均属于碱性氧化物 D. Na2O和Na2O2均与CO2反应
难度: 简单查看答案及解析
-
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
A. 根据是否含氧元素,将物质分为氧化剂和还原剂
B. 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C. 根据水溶液是否能够导电,将物质分为电解质和非电解质
D. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 简单查看答案及解析
-
若NA为阿伏加德罗常数,则下列叙述正确的是
A. 标准状况下,12 g C60中含有的碳原子数为NA
B. 3.9 g金属钾变为钾离子时,失去的电子数为NA
C. 标准状况下,22.4 L以任意比例混合的CO2与CO气体中含有的碳原子数约为2NA
D. 在1 L 1 mol·L-1的盐酸中,所含氢原子数约为NA
难度: 简单查看答案及解析
-
设阿伏伽德罗常数的值为NA,下列说法正确的是:
A.0.5mol的NaHSO4固体中含有的阴离子总数为NA
B.0.1mol/L FeCl3的溶液中,含Cl-数目为0.3 NA
C.标准状况下22.4LNO2气体与水完全反应时,转移电子数目为NA
D.常温常压下,23gNO2和N2O4的混合气体中总原子数目为1.5 NA
难度: 中等查看答案及解析
-
448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
A. 64g B. 64 C. 64g·mol-1 D. 32g·mol-1
难度: 简单查看答案及解析
-
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 蒸发结晶时应将溶液蒸干
D. 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌
难度: 中等查看答案及解析
-
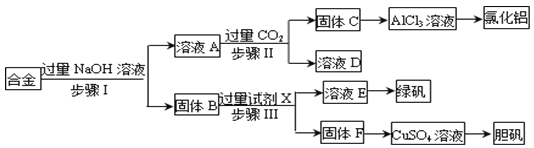
下列关于金属冶炼的说法不正确的是 ( )
A. 金属冶炼是指用化学方法将金属由化合态转变为游离态
B. 天然矿藏很少只含有一种金属元素,往往含有较多杂质
C. 金属的冶炼方法主要有热分解法,热还原法和电解法三种方法
D. 金属冶炼一定要用到还原剂
难度: 简单查看答案及解析
-
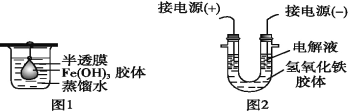
在下列现象中,不能用胶体的有关知识解释的是( )
A. 在河流入海口处易形成三角洲
B. 将FeCl3饱和溶液滴到沸水中,得到红褐色液体
C. 在NaCl溶液中加入KNO3溶液看不到沉淀
D. 同一支钢笔同时使用不同牌号的墨水可能发生堵塞
难度: 简单查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
除去MgO中的Al2O3可选用的试剂是( )
A. NaOH溶液 B. 硝酸 C. 浓硫酸 D. 稀盐酸
难度: 中等查看答案及解析
-
既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的化合物是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A. ①②③ B. ①④ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
下列有关物质的性质与用途不正确的是
A. 明矾溶于水后可得到少量的有强吸附性的Al(OH)3,故明矾可作净水剂
B. Na2O2可用于呼吸面具或潜水艇中的供氧剂
C. 用热的纯碱洗去油污是因为Na2CO3可直接与油污反应
D. Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是:
①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性;
A. ①③ B. ②⑤ C. ③⑤ D. ②④
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 氢氧化钡溶液与足量硫酸氢钠的溶液混合:Ba2++OH―+H++SO42―=BaSO4↓+H2O
B. 过量的铁溶于稀硝酸:Fe+4H++NO3―=Fe3++NO↑+2H2O
C. 氯气与水:Cl2+H2O
2H++Cl―+ClO―
D. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A. 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B. FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
C. Cu溶于稀HNO3:Cu+4H++NO3-=Cu2++NO2↑+2H2O
D. 过量CO2通入氢氧化钠溶液中:OH-+CO2=HCO3-
难度: 简单查看答案及解析
-
巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是( )
A. Al3+、CH3COO—、Cl— B. Mg2+、Ba2+、Br—
C. Mg2+、Cl—、I— D. Na+、NH4+、Cl—
难度: 简单查看答案及解析
-
在下述条件下,一定能大量共存的离子组是( )
A. 无色透明的水溶液中:K+、Ba2+、I—、MnO4—
B. 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42—、H+
C. c (HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32—、Br—
D. 酸性溶液中:ClO-、S2—、SO32—、Na+
难度: 简单查看答案及解析
-
下列不能用来鉴别Na2CO3和NaHCO3两种无色固体的实验操作是( )
A. 分别加热这两种固体,并将生成的气体通入澄清石灰水中
B. 分别在这两种物质中加入CaCl2溶液
C. 在两种固体物质中加入等浓度的稀盐酸
D. 分别在两种物质的溶液中加入澄清石灰水
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 凡能电离出H+的化合物均属于酸 B. 醋酸溶液的导电能力可能比稀硫酸强
C. SO3的水溶液能导电,SO3是电解质 D. 硫磺不导电,因此硫磺是非电解质
难度: 简单查看答案及解析
-
下列几种物质氧化性由强到弱顺序如下:KMnO4>Cl2>FeCl3>I2。则除去FeCl2溶液中混有的I–应选用 ( )
A. KMnO4 B. Cl2 C. I2 D. FeCl3
难度: 简单查看答案及解析
-
已知:Na2O2+CO2→Na2CO3+O2(未配平),关于该反应的说法中正确的是( )
A. 生成0.1 mol O2转移0.4mol电子
B. 相同条件下足量Na2O2吸收10LCO2放出5LO2
C. 氧化剂是Na2O2,还原剂是CO2
D. 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同
难度: 简单查看答案及解析
-
歌曲《青花瓷》,唱道“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O=Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A. 该反应不属于氧化还原反应
B. 该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C. 该反应中铜得电子,O2失电子,所以是氧化还原反应
D. 该反应是氧化还原反应,化合价发生改变的只有两种元素
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是
①Al2O3
 NaAlO2(aq)
NaAlO2(aq)Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是

A. 配平后的化学计量数依次为3、1、2、6、3
B. 若有1mol的S被氧化,则生成2mol S2-
C. 氧化剂与还原剂的物质的量之比为1:2
D. 2mol的S参加反应有3mol的电子转移
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中一种优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF,下列有关该反应的说法正确的是
A. NF3是氧化剂,H2O是还原剂 B. HF是还原产物
C. 还原剂和氧化剂的物质的量之比是2∶1 D. NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析