-
下列说法正确的是( )
A. 原子的L层上的电子数为奇数的元素一定是主族元素
B. 同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1
C. 相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D. 主族序数等于周期序数的元素一定为金属元素
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. SiO2是酸性氧化物,能与NaOH溶液反应
B. NO2与水反应氧化剂与还原剂物质的量比为2:1
C. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D. 铁露置在空气中一段时间后会生锈;性质更活泼的铝不能稳定存在于空气中
难度: 简单查看答案及解析
-
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4 B. 1:5 C. 2:3 D. 2:5
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A. 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B. 青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C. 铁容器可以盛放浓盐酸、浓硝酸、浓硫酸
D. 漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
难度: 中等查看答案及解析
-
下列离子方程式中书写正确的是( )
A. 铝与盐酸反应 Al+H+═Al3++H2↑
B. 硫酸铜与Ba(OH)2溶液反应 Cu2++2OH﹣═Cu(OH)2↓
C. 铁与FeCl3溶液反应 Fe+Fe3+═2Fe2+
D. 硝酸银溶液与氯化钠溶液反应 Ag++Cl﹣═AgCl↓
难度: 中等查看答案及解析
-
下列装置中,可用于实验室制取氨气的是( )
A.
 B.
B.  C.
C. 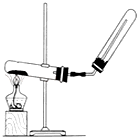 D.
D. 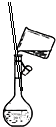
难度: 简单查看答案及解析
-
有关氨的说法不正确的是( )
A. NH3是4核10电子的分子,具有还原性
B. NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂
C. 氨气是非电解质,氨水是电解质
D. 氨分子中氮原子最外层电子数为8
难度: 中等查看答案及解析
-
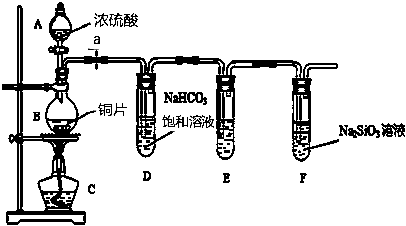
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应.二者比较,相等的是(溶液体积变化忽略不计)( )
①铜片消耗完所需时间; ②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数; ④反应后溶液中铜离子的浓度.
A. ①③ B. ②④ C. ③④ D. 只有①
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均正确的是( )
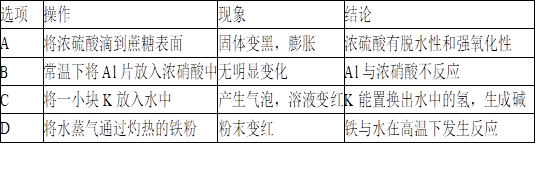
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质都具有漂白作用,其中漂白原理没有利用物质化学性质的是( )
A. 过氧化钠 B. 二氧化硫 C. 双氧水 D. 活性炭
难度: 中等查看答案及解析
-
据报道,某些建筑材料会产生放射性同位素氡
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
A. 136 B. 50 C. 86 D. 222
难度: 简单查看答案及解析
-
下列化学用语书写正确的是( )
A. 氯离子的结构示意图:
B. 作为相对原子质量测定标准的碳核素:
C
C. 氯化镁的电子式:
D. 用电子式表示氯化氢分子的形成过程:
+
→
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl﹣、S2﹣四种粒子的离子半径依次减小
C.
Po、
Po、
Po三种原子的核外电子数分别为124、125、126
D. 第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
难度: 中等查看答案及解析
-
下列物质的性质比较,正确的是( )
A. 酸性:H2SO4>HClO4>HBrO4
B. 碱性:NaOH>KOH>RbOH
C. 非金属性:P>S>Cl
D. 气态氢化物稳定性:HF>H2O>PH3
难度: 简单查看答案及解析
-
X元素的最高价氧化物对应的水化物的化学式为 H2XO3,则它对应的气态氢化物的化学
式为( )
A. HX B. H2X C. XH3 D. XH4
难度: 简单查看答案及解析
-
核电荷数小于18的某元素X,其原子的电子层数n,最外层电子数为(2n+1),原子核内质子数为(2n2﹣1).下列关于元素X的说法中,不正确的是( )
A. 其最高化合价为+3价
B. 可以形成化学式为KXO3的盐
C. 其氢化物可以用来做喷泉实验
D. 其最高价氧化物的水化物是强酸
难度: 中等查看答案及解析
-
为说明氯比硫的非金属性强,下列事实可作依据的是( )
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2﹣能被Cl2氧化
D. HClO的氧化性强于H2SO4
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn﹣和dRm﹣(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a﹣b=m﹣n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y.
A. ②③ B. ③ C. ①②③④ D. ①②③
难度: 中等查看答案及解析