-
( )关于F-微粒叙述正确的是
A.质量数为19,电子数为9 B.质子数为9,中子数为9
C.质子数为9,电子数为10 D.中子数为10,电子数为8
难度: 简单查看答案及解析
-
( )下列反应过程中,能量变化符合右图的是
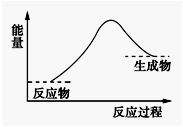
A.Zn与盐酸反应
B.CaO与H2O反应
C.NaOH溶液与盐酸反应
D.消石灰与NH4Cl固体反应
难度: 简单查看答案及解析
-
( )下列试剂保存或盛放方法正确的是
A.浓硝酸盛放在铜质器皿中
B.稀硝酸盛放在铁质器皿中
C.NaOH溶液保存在带橡胶塞的试剂瓶中
D.NaOH溶液保存在带玻璃塞的试剂瓶中
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A. Cl与Cl得电子能力相同
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 中等查看答案及解析
-
( )已知原子序数为a的ⅡA族元素X和原子序数为b的ⅢA族元素Y位于元素周期表中同一周期,下列的量值关系不正确的是
A.b=a+30 B.a=b-11
C.b=a+25 D.a=b-1
难度: 中等查看答案及解析
-
( )亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是D
A.NH3 B.N2 C.N2O3 D.HNO3
难度: 简单查看答案及解析
-
( )下列各项中表达正确的是
A.H、D、T表示同一种核素
B.F-离子结构示意图
C.用电子式表示HCl形成过程
D.B次氯酸电子式
难度: 中等查看答案及解析
-
( )下列关于SO2的叙述,正确的是A
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
难度: 简单查看答案及解析
-
( )下列分子中所有原子都满足最外层8电子稳定结构的是
A.五氯化磷(PCl5) B.次氯酸(HClO)
C.二氧化碳(CO2) D.三氟化硼(BF3)
难度: 中等查看答案及解析
-
( )向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
难度: 中等查看答案及解析
-
( )X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是
A.Y的阴离子Y-的还原性强于X的阴离子X-
B.X的氢化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
C.X的单质X2能将Y的阴离子Y-氧化成Y2
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
难度: 中等查看答案及解析
-
( )在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是
A.1∶0.45 B.1∶1
C.1∶0.29 D.4.5∶2.9
难度: 中等查看答案及解析
-
( )已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 中等查看答案及解析
-
( )已知2H→H2放出437.6 kJ的热量,下列说法正确的是
A.氢气分子内每个氢原子都达到了8电子稳定结构
B.1 mol H2的能量比2 mol H的能量低
C.1 mol H2离解成2 mol H要放出437.6 kJ热量
D.氢原子不如氢分子活泼
难度: 中等查看答案及解析
-
( )下列各组气体,在通常情况下既能用浓硫酸又能用碱石灰干燥的有
A.SO2、O2、N2 B.HCl、Cl2、CO2
C.CH4、H2、CO D.SO2、Cl2、O2
难度: 中等查看答案及解析
-
( )下列说法正确的是
A.在化学反应中某元素由化合态变为游离态,该元素一定被还原了
B.失电子难的原子其得电子的能力一定强
C.电子层结构相同的各种离子,它们的半径随核电荷数的增加而减小
D.最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼
难度: 中等查看答案及解析
-
( )X、Y、W、R、T是前17号元素中的5种,X、Y位于同主族,Y原子的最外层电子数与次外层电子数相等,R原子的最外层电子数为次外层电子数的3倍,T无正价,W单质用于制造计算机芯片,下列说法不正确的是
A.气态氢化物稳定性:W<T B.离子半径:X<R
C.最高价氧化物对应水化物碱性:X>Y D.Y单质能与冷水剧烈反应
难度: 中等查看答案及解析
-
( )下列结论正确的是
①粒子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.②③⑤⑦ B.②⑥⑦ C.②④⑤⑥⑦ D.②④⑥
难度: 中等查看答案及解析
-
( )14g铜银合金跟足量的某浓度HNO3反应,将放出的气体与1.12LO2(标况)混合,通入水中,恰好全部吸收,则合金中铜的质量是
A.1.6g B.3.2g C.6.4g D.9.6g
难度: 中等查看答案及解析
-
( )现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是
元素
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑪
原子半径
(10-10m)
-
0.37
0.74
0.75
0.77
0.82
0.99
1.10
1.52
1.60
1.86
最高或最低化合价
0
+1
+5
+4
+3
+7
+5
+1
+2
+1
-2
-3
-4
-1
-3
A.上表中11种元素中形成的非金属单质都有非极性共价键
B.②⑨处于同一周期,④⑧处于同一主族
C.上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
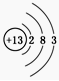
D.⑥原子结构示意图为:
难度: 中等查看答案及解析
