-
下列物质中,不属于电解质的是
A.H2SO4 B.AgCl C.NaOH D.酒精
难度: 简单查看答案及解析
-
在进行蒸馏操作中,加热一段时间后,发现碎瓷片忘加,应采取的正确操作是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
难度: 简单查看答案及解析
-
下列实验操作均要用到玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体
A.①和④ B.①和③ C.①和② D.③和④
难度: 简单查看答案及解析
-
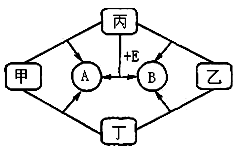
某国外化学教材中有一张关于氧化还原反应的插图:

由图可知,
在该反应中是
A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
难度: 简单查看答案及解析
-
下列各组中两个溶液的反应,均可用同一离子方程式表示的是
A.CH3COOH溶液和Na2CO3溶液;CH3COOH溶液和NaHCO3溶液
B.CaCO3和HCl溶液;Na2CO3和HCl溶液
C.BaCl2溶液和Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
D.KOH溶液和CH3COONH4溶液;Ba(OH)2溶液与NH4Cl溶液
难度: 简单查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Ag+、Na+、Cl-、K+
B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.Ba2+、HCO3-、NO3-、K+
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.0.5molO3与11.2LO2所含的分子数一定相等
C.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
D.500mL 1mol/LNa2SO4溶液中含Na+数目为NA
难度: 中等查看答案及解析
-
已知反应①2BrO3- + Cl2 = Br2 +2ClO3- ②5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
③ClO3- + 5Cl- + 6H+ = 3Cl2 + 3H2O,下列粒子氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2
B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->C1O3->IO3-
难度: 中等查看答案及解析
-
在体积相同的密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法中正确的是
A.两种气体的压强相等
B.两种气体的氧原子数相等
C.两种气体的分子数目相等
D.O2比O3质量小
难度: 简单查看答案及解析
-
下列有关实验操作中,正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C.用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
难度: 简单查看答案及解析
-
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2 mol/L B.1 mol/L C.0.4 mol/L D.0.2 mol/L
难度: 困难查看答案及解析
-
一定量的质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质质量分数恰好扩大一倍,体积变为62.5 mL,则浓缩后溶液的物质的量浓度为
A.2.2 mol/L B.4 mol/L C.5 mol/L D.6.25 mol/L
难度: 中等查看答案及解析
-
将0.2mol·L-1Ba(OH)2溶液与0.05mol·L-1NaHSO4溶液等体积混合后,下列几种离子浓度大小顺序正确的是
A.c(Ba2+)>c(OH-)>c(Na+)>c(SO42-)
B.c(Na+)>c(OH-)>c(Ba2+)>c(SO42-)
C.c(Na+)>c(Ba2+)>c(OH-)>c(SO42-)
D.c(OH-)>c(Ba2+)>c(Na+)>c(SO42-)
难度: 中等查看答案及解析
-
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
A.0.01 mol·L-1的蔗糖溶液
B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液
D.0.02 mol·L-1的CH3COOH溶液
难度: 中等查看答案及解析
-
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A.7∶2
B.5∶4
C.3∶5
D.2∶7
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
①生成42.0 L N2(标准状况)
②有0.250 mol KNO3被氧化
③转移电子的物质的量为1.25 mol
④被氧化的N原子的物质的量为3.75 mol
A.①② B.③④ C.②③ D.①④
难度: 中等查看答案及解析