-
2017 年 12 月,全球首条光伏高速公路亮相济南。下列有关说法正确的是( )

A. 光伏发电将化学能转变为电能 B. 光伏发电代替燃煤发电可减少雾霾
C. 汽车尾气中的 CO2 会造成酸雨 D. 光伏发电所用太阳能电池板的主要材料是二氧化硅
难度: 简单查看答案及解析
-
下列对能源的看法不合理的是( )
A. 风能是人类通过风车等工具获取的能源,但属于一次能源
B. 生物质能是一种可再生能源,有广泛的应用前景
C. 太阳能、氢能、核能、地热能都属于新能源
D. 化石燃料与人类生活密切相关,要多开采,多使用
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下,22.4L 氮气所含分子数为 NA
B. 1molC2H6 中含有极性键的数目为 7NA
C. 17gNH3中含有的电子数为 8NA
D. 在标准状况下, 1.12L16O2和 1.12L18O2 均含有 0.1NA个氧原子
难度: 中等查看答案及解析
-
下列有关化学用语表达不正确的是( )
A. 甲烷的结构式:CH4 B. 质子数为 53,中子数为 78 的碘原子:
C. Na 的原子结构示意图:
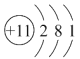 D. 钙离子的电子式: Ca2+
D. 钙离子的电子式: Ca2+难度: 简单查看答案及解析
-
已知短周期元素的四种离子 A2+、 B+、 C3-、 D-具有相同的电子层结构,则下列叙述中正确的是 ( )
A. 原子序数: D>C>B>A B. 离子半径: C3->D->A2+>B+
C. 原子半径: B>A>C>D D. 氧化性: A2+>B+,还原性: C3-<D-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 碱金属元素单质的熔点随原子序数递增而降低
B. 同种元素的原子均有相同的质子数和中子数
C. 族序数等于其周期序数的元素一定是金属元素
D. ⅦA 族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 简单查看答案及解析
-
自热食品已成为现代生活的时尚。自热食品包装中有两包发热剂,在这两包发热剂中最适合盛放的物质是( )
A. 浓硫酸和水 B. 氯化铵和氢氧化钡晶体 C. 氯化钠和水 D. 生石灰和水
难度: 简单查看答案及解析
-
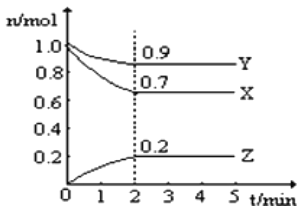
在一定条件下,将3 mol A 和 1 mol B 两种气体混合于固定容积为 2 L 的密闭容器中,发生如下反应: 3A(g)+B(g)
xC(g)+2D(g)。 2 min 末该反应达到平衡,测得生成 0.8 mol D,0.4 molC。下列判断正确的是( )
A. x=2 B. 2 min 时, A 的浓度为 1.2mol·L-1
C. 2 min 内 A 的反应速率为 0.6 mol·L-1·min-1 D. B 的转化率为 60%
难度: 中等查看答案及解析
-
下列有关化学键的说法中正确的是( )
A. 碘晶体升华和冰熔化时都涉及化学键的变化
B. 氯化钠熔化或氯化氢溶于水时都要破坏化学键
C. 离子化合物中可能含有共价键,共价化合物中可能含有离子键
D. 氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
难度: 简单查看答案及解析
-
在一个固定容积的密闭容器中,可逆反应m A(g)+n B(g)
p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变 ②体系的密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A. ③④⑤⑥ B. ③④⑥ C. ①③④ D. ②③⑥
难度: 中等查看答案及解析
-
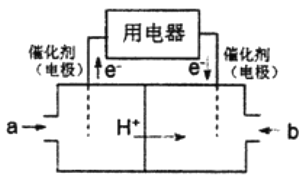
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的工作原理如图所示。下列说法正确的是( )
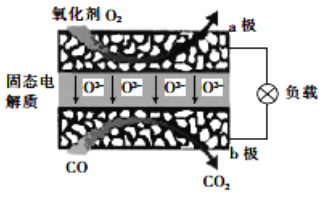
A. 正极的电极反应式为 O2+4e-+2H2O===4OH-
B. 还可以选用 NaOH 固体作固态电解质
C. 若反应中转移 1 mol 电子,则生成 22.4LCO2
D. 电子从 b 极经导线流向 a 极
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A. 离子半径: O2->F->Na+>Al3+ B. O2和 O3 互为同素异形体
C.
和
互为同分异构体 D. CH4和 C2H6 互为同系物
难度: 简单查看答案及解析
-
国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了, 每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
A. 水分子中所有原子都满足 8 电子结构
B. 1molH2O 中含有非极性键的数目为 2NA
C. 宇航员喝茶时注入的 H2O 的摩尔质量是 18g
D. 氢的三种同位素 1H、 2D、 3T 与 16O 可形成多种水分子,其相对分子质量有 5 种
难度: 简单查看答案及解析
-
在离子 RO3n 中, 共有 x 个核外电子,R 原子的质量数为 A,则 R 原子核内含有的中子数目是( )
A. A-x+n+24 B. A-x+n+48
C. A-x-n-24 D. A+x-n-24
难度: 中等查看答案及解析
-
下列推测或结论不合理的是( )
A. 砹(At)为有色固体, AgAt 难溶于水也不溶于稀硝酸
B. X2-和 Y+核外电子层结构相同,原子序数: X<Y
C. 由水溶液的酸性: HCl>H2S,可推断出元素的非金属性: Cl>S
D. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
难度: 中等查看答案及解析
-
如图是周期表中短周期的一部分, W、 X、 Y 三种元素原子核外电子数之和等于 X的质量数, X 原子核内质子数和中子数相等。下列叙述中不正确的是( )
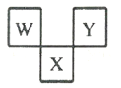
A. X 或 W 的某种氧化物的排放均可形成酸雨
B. Y 的单质具有很强的氧化性,能从 KI 溶液中置换出 I2
C. W 最高价氧化物对应水化物和气态氢化物可反应生成盐
D. 三种元素的原子半径的大小顺序为: X>W>Y
难度: 中等查看答案及解析