-
2011年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路——“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
难度: 简单查看答案及解析
-
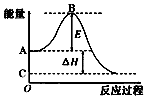
下列物质间的反应,其能量变化符合下图的是( )

A.由Zn和稀H2SO4制氢气
B.灼热的炭粉与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
难度: 简单查看答案及解析
-
下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.由C(石墨) =C(金刚石) ΔH > 0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ/mol
难度: 中等查看答案及解析
-
已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)=8CO2(g)+9H2O(l)ΔH=-48.40kJ·mol-1
B.C8H18(l)+O2(g)=8CO2(g)+9H2O(l)ΔH=-5518
kJ·mol-1
C.C8H18(l)+O2(g)=8CO2(g)+9H2O(l)ΔH=+5518kJ·mol-1
D.C8H18(l)+O2(g)=8CO2(g)+9H2O(l)ΔH=+48.40kJ·mol-1
难度: 中等查看答案及解析
-
已知:① 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ·mol-1 。下列判断正确的是( )
A.1 mol氢气完全燃烧生成液态水吸收热量241.8 kJ
B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ
C.由①②知,水的热稳定性小于硫化氢
D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ
难度: 中等查看答案及解析
-
下列关于化学平衡的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等都等于0
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学平衡不可以通过改变条件而改变
难度: 简单查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
难度: 中等查看答案及解析
-
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的体积分数减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
难度: 困难查看答案及解析
-
将NO2装入带有活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.自发进行的反应一定是放热反应 B.非自发进行的反应一定是吸热反应
C.自发进行的反应一定能发生 D.有些吸热反应也能自发进行
难度: 简单查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
难度: 简单查看答案及解析
-
一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)
pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新
的平衡时,气体C的浓度变为原平衡时的1.9倍
,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向正反应方向移动 D.C的质量分数增加
难度: 困难查看答案及解析
-
反应Fe(s)+CO2(g)
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
难度: 困难查看答案及解析
-
下列对熵的理解不正确的是( )
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵
值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25 ℃、1.01×105
Pa时,2N2O5(g)=4NO2(g)+O2(g)是熵增的反应
难度: 中等查看答案及解析
-
有一反应:2A+B
2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )

A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v正<v逆
难度: 困难查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
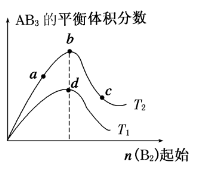
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
难度: 中等查看答案及解析
-
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
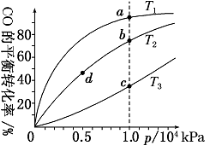
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
难度: 困难查看答案及解析
-
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X(g)+2Y(g)
2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
难度: 中等查看答案及解析
-
N2O5在一定温度下可发生下列反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s
0
500
1 0
00
1 500
c(N2O5)/mol/ L
5.00
3.52
2.50
2.50
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的
平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
难度: 困难查看答案及解析
-
下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是( )
纯净物
混合物
强电解质
弱电解质
非电解质
A
纯盐酸
水煤气
硫酸
醋酸
干冰
B
冰醋酸
空气
硫酸钡
亚硫酸
二氧化硫
C
氯气
盐酸
苛性钠
氢硫酸
碳酸钙
D
漂白粉
氨水
氯化钠
次氯酸
氯气
难度: 中等查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的体积相等,则下列说法正确的是( )
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥ C.②③⑤ D.②③⑥
难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的事实是( )
A.醋酸溶液的导电性比盐酸弱
B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C.醋酸溶液用水稀释后,氢离子浓度下降
D.0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L
难度: 简单查看答案及解析
-
下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12[
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.多元弱酸的各步电离之间无影响
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
难度: 中等查看答案及解析
-
室温下向10 mL 0.1 mol/L的醋酸溶液中加水稀释并达到新平衡后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.平衡时,溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液的pH减小
难度: 中等查看答案及解析