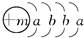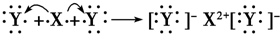-
A、B、C三种元素的原子序数依次为a、b、c,它们的离An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )
A.a>b>c
B.a>c>b
C.a=b+m-n
D.a=c-n-m难度: 中等查看答案及解析
-
已知放热反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),则下列叙述不 正确的是( )
A.该反应中旧键断裂所吸收的能量大于新键形成所放出的能量
B.该反应放出热量的多少与反应物的用量有关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量难度: 中等查看答案及解析
-
在下列水溶液中进行的各反应中,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
A.2NaBr+Cl2=2NaCl+Br2
B.2AgOH=Ag2O+H2O
C.2Na+2H2O=2NaOH+H2↑
D.2Na2O2+2H2O=4NaOH+O2↑难度: 中等查看答案及解析
-
已知H++OH-=H2O生成1mol H2O放出热量57.3kJ,下列反应中放出57.3kJ热量的是( )
A.1mol稀H2SO4与足量NaOH溶液反应
B.稀盐酸与氨水反应生成1molH2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水
D.稀NaOH与95%浓硫酸生成1mol水难度: 中等查看答案及解析
-
有下列符号:35Cl和37Cl、O2和O3、1H216O和2H218O.下列有关说法正确的是( )
A.35Cl和37Cl互称为同素异形体
B.O2和O3是氧元素的两种同位素
C.35和37表示的是质量数
D.1H216O和2H218O的相对分子质量相同难度: 中等查看答案及解析
-
下列有关物质性质的比较中,正确的是( )
①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl- ③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O.
A.①③
B.②④
C.①④
D.②③难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在原子核外电子排布中,当M层是最外层时,该层最多只能排布8个电子
B.电子的能量越低,运动区域离核越远
C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素
D.第三周期元素的离子半径随原子序数的增加而依次减小(Ar除外)难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是( )
A.CO2的比例模型: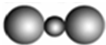
B.NH4Cl的电子式为: Cl-
Cl-
C.HClO的结构式:H-O-Cl
D.14C的原子结构示意图: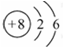
难度: 中等查看答案及解析
-
共价键、离子键和分子间作用力是物质间的不同作用力,下述物质中只含上述一种作用力的是( )
A.干冰
B.氯化钠
C.氢氧化钠
D.碘难度: 中等查看答案及解析
-
现有两种短周期元素A、B的原子序数分别为a、b,若a+8=b,则下列有关A、B的说法正确的是( )
A.A和B一定在同主族
B.A和B一定在同周期
C.若A和B在相邻周期,则A、B一定同主族
D.A、B可能既不同周期,又不同主族难度: 中等查看答案及解析
-
俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子.这4个原子生成数微秒后衰变成第113号元素.下列有关叙述正确的是( )
A.115号元素在第六周期
B.113号元素在第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期难度: 中等查看答案及解析
-
有a、b、c、d四种元素,a、b为同周期元素,c、d为同主族元素.已知a的阳离子和d 的阴离子具有相同的电子层结构.b的阴离子和c的阴离子电子层结构相同.且c离子所带的电荷数大于b离子.则下列说法正确的是( )
①原子序数d<b<c<a ②原子序数d<a<c<b ③原子序数d<a<b<c
④离子半径b>c>d>a ⑤离子半径b>c>a>d ⑥离子半径c>b>d>a.
A.③④
B.②⑥
C.①⑤
D.②④难度: 中等查看答案及解析
-
由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20.则有关X的下列说法中正确的是( )
A.X中阳离子和阴离子个数不一定相等
B.X中一定有离子键,一定不含共价键
C.若X只含两种元素,则这两种元素可在同一周期也可在同一主族
D.X中阳离子半径一定大于阴离子半径难度: 中等查看答案及解析
-
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
2011.3.18,实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
A.①②③
B.②④
C.②③④
D.③④⑤难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)
B.SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构
C.同素异形体之间的相互转化都属于物理变化
D.由ⅠA族和ⅥA族短周期元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子型化合物难度: 中等查看答案及解析
-
将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片难度: 中等查看答案及解析
-
下列说法正确的是( )
A.硫粉在过量的纯氧中燃烧可以生成SO3
B.可以用澄清石灰水鉴别SO2和CO2
C.SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性
D.SO2通入到紫色石蕊试液中,溶液只变红不褪色难度: 中等查看答案及解析
-
将标准状况下NO2和O2按体积比4:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为( )
A.mol•L-1
B.×
mol•L-1
C.×
mol•L-1
D.mol•L-1
难度: 中等查看答案及解析