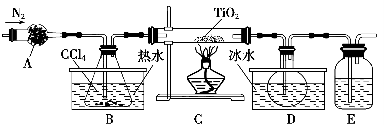
-
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是
_______________________________________________________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是___________________________________________
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
难度: 极难查看答案及解析
-
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】 ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
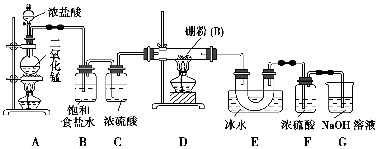
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:_______________________。
(2)E装置的作用是_______________________________________。
如果拆去B装置,可能的后果是_______________________________________
_________________________。
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________________________;
实验室保存三氯化硼的注意事项是__________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:
________________________________________________________________。
难度: 困难查看答案及解析
-
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验编号
初始pH
废水样品体积/mL
草酸溶液体积/mL
蒸馏水体积/mL
①
4
60
10
30
②
5
60
10
30
③
5
60
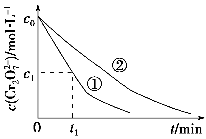
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
实验方案(不要求写具体操作过程)
预期实验结果和结论
难度: 困难查看答案及解析
-
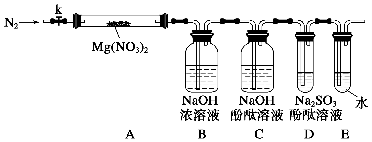
某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。
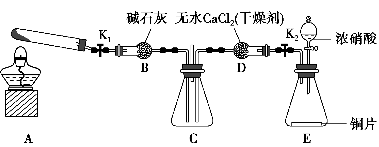
(1)E装置中制取NO2的化学反应方程式是____________________________
____________________________________________。
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是________________________________________________________________。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______________________________________________________________。
(4)此实验装置中一个明显的缺陷是__________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________________。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。
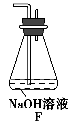
①装置的合理连接顺序是(某些装置可以重复使用)________。
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为__________________________________
难度: 极难查看答案及解析
-
某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】 将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在 其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘 附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是:
_________________________________________________________________。
(2)燃烧的本质是:_____________________________________________。
(3)2010年8月初发生的俄罗斯森林大火着火面积比伦敦市的面积还要大。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延:_____________________________________________________________。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】 该小组对燃烧后的白色产物进行如下探究:
实验方案
实验操作
实验现象
结论
方案1
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液
溶液变成红色
白色物质为Na2O
方案2
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液
出现白色沉淀
②静置片刻,取上层清液于试管中,滴加无色酚酞试液
无明显现象
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是:___________________________________
(5)乙同学认为方案2得到的结论正确,白色物质为:________。
(6)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是:_____________________________________________________。
(7)钠在二氧化碳中燃烧的化学方程式为:____________________________
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
________________________________________________________
难度: 困难查看答案及解析