-
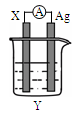
根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2↓+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B﹣2e-=B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是
A.D2+>A2+>B2+>E2+ B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+ D.E2+>B2+>A2+>D2+
难度: 中等查看答案及解析
-
化学是社会生活联系最为紧密的学科之一,下列有关化学与生活说法错误的是
A.利用石油中各组分沸点的不同,通过分馏的方法可以获得汽油、煤油、柴油
B.不加糖不等于没有糖,糖尿病人应该注意日常饮食
C.水果散发出诱人的香味,其主要成分是一种低级酯类物质
D.煤的干馏属于物理变化
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏加德罗常数的值)
A.在常温常压下,1 mol 氖气含有的原子数为2 NA
B.1 mol Na2O2中含有O22-数目为NA
C.1 mol/L的NaCl溶液中Na+数为NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律的表述正确的是
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第VIA族元素的原子最高正价等于主族序数
④原子序数为12的元素位于元素周期表的第三周期第IIA族
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
下列有关胶体的说法错误的是
A.胶体与溶液的本质区别是胶体粒子的直径1-100 nm
B.胶体粒子很小,能透过半透膜
C.向氢氧化铁胶体中滴加盐酸,可能的现象是先产生红褐色沉淀,后沉淀逐渐溶解
D.雾是气溶胶,在阳光的照射下可见到丁达尔现象
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、电解质、非电解质的正确组合为
纯净物
混合物
电解质
非电解质
A
盐酸
冰水混合物
硫酸
干冰
B
蒸馏水
蔗糖溶液
氧化铝
二氧化硫
C
胆矾
盐酸
铁
碳酸钙
D
胆矾
食盐水
氯化铜
碳酸钠
难度: 中等查看答案及解析
-
下列说法正确的是
A.H2、D2和T2互称为同素异形体
B.
和
互称为同分异构体
C.35Cl和37Cl 互称为同位素
D.C2H4与C4H8一定能互称为同系物
难度: 中等查看答案及解析
-
某有机物的结构如图所示,则下列说法中正确的是
A.1 mol该有机物能与2 mol Na反应
B.该有机物能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
C.该有机物中有4种官能团
D.该有机物能发生加成反应但不能发生取代反应
难度: 中等查看答案及解析
-
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是

A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
难度: 中等查看答案及解析
-
下列各组离子,能在溶液中大量共存的是
A.Fe2+、Ba2+、H+、NO3- B.Ba2+、Na+、CO32-、 OH-
C.K+、Mg2+、SO42-、Cl- D.H+、 K+、 CO32-、 SO42-
难度: 中等查看答案及解析
-
相同状况下,等质量的O2和CO2相比较,下列叙述正确的是
A.体积比为8︰11
B.分子个数之比为1︰1
C.物质的量之比为11︰8
D.原子个数之比为12︰11
难度: 中等查看答案及解析
-
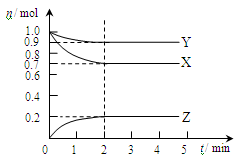
同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是
A.原子半径:X>Y>Z
B.非金属性:X>Y>Z
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+
B.Ba(OH)2溶液与稀H2SO4混合:2H++2OH-=2H2O
C.少量铁粉加入稀硝酸中 :Fe + NO3-+ 4H+=Fe2+ + NO↑ + 2H2O
D.钠放入水中:Na+H2O=Na++OH-+H2↑
难度: 中等查看答案及解析
-
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是
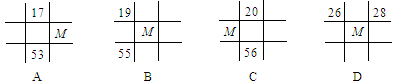
难度: 简单查看答案及解析
-
下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.KI和HI中化学键类型完全相同
C.Na2O2中既含有离子键又含有非极性共价键
D.NH4Cl中只含有共价键
难度: 中等查看答案及解析
-
下列参数比较及解释均正确的是
选项
参数
比较
解释
A
沸点
HF<HCl<HI
组成结构相似的物质,相对分子质量越大沸点越高
B
半径
Na+<Mg2+<Al3+
同一周期粒子半径随原子序数的递增逐渐减小
C
酸性
H2SO3>H2CO3
元素的非金属性越强,其含氧酸的酸性越强
D
还原性
P3->S2->Cl-
元素的非金属性越强,简单阴离子的还原性越弱
难度: 困难查看答案及解析
-
C4H10的一氯代物的数目为
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
X、Y均为短周期元素,其简单离子aXn-和bYm+电子层结构相同,则下列说法正确的是
A.b-a=m+n B.X的原子半径大于Y
C.X的族序数一定小于Y D.X不可能是氢元素
难度: 中等查看答案及解析
-
某学生配制一定物质的量浓度的氢氧化钠溶液,其中不会使溶液浓度偏低的是
A.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
B.容量瓶刚用蒸馏水洗净,没有烘干
C.定容时,加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
D.定容时仰视刻度线
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是

难度: 中等查看答案及解析