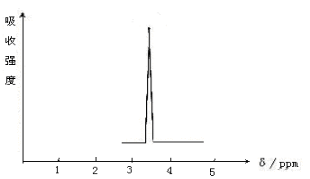-
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。我市已将PM2.5列入空气质量播报指标。下列有关说法中不正确的是
A.空气中PM2.5含量较高时,容易引起呼吸系统疾病
B.国家应该大力开发和使用太阳能、风能、天然气等可再生能源来降低环境污染
C.PM2.5的颗粒在空气中不能形成气溶胶
D.研制开发燃料电池汽车,减少机动车尾气排放,某种程度可以减少空气中PM2.5含量
难度: 中等查看答案及解析
-
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:3NH3+3CO2→
 +3H2O。下列有关三聚氰胺的说法正确的是
+3H2O。下列有关三聚氰胺的说法正确的是A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
难度: 中等查看答案及解析
-
氡(
Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来。它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线。这些射线可诱发肺癌。关于氡的下列叙述不正确的是
A.Rn的原子核内中子数与质子数的差值为50
B.Rn位于元素周期表中第六周期0族
C.Rn的最外层电子排布式为6s26p6,化学性质不活泼
D.新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害
难度: 中等查看答案及解析
-
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2
CO2+H2O
下列有关说法正确的是
A.该反应为放热反应 B.CO2分子中的化学键为非极性键
C.HCHO分子中只含α键不含π键 D.设生成1.8gH2O消耗2.24L O2
难度: 中等查看答案及解析
-
纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因。假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式
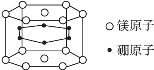
A.Mg3B6 B.Mg14B6 C.MgB2 D.Mg5B12
难度: 困难查看答案及解析
-
据报道2010年5月俄罗斯特种部队在解救索马里海盗人质时,除使用了非致命武器“芬太奴”外,还使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是
1
2
3
4
5
6
7
8
9
…
C2H2
C2H4
C2H6
C3H4
C3H6
C3H8
C4H6
C4H8
C4H10
…
A.C6H12 B.C6H14 C.C7H12 D.C7H14
难度: 中等查看答案及解析
-
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得。

下列有关说法不正确的是
A.该反应是取代反应
B.苯酚和羟基扁桃酸不是同系物
C.乙醛酸能使酸性KMnO4溶液褪色
D.1 mol羟基扁桃酸能与2 mol NaOH反应
难度: 中等查看答案及解析
-
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有
A.32 B.16 C.8 D.4
难度: 困难查看答案及解析
-
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用燃烧法
C.利用红外光谱法 D.利用核磁共振氢谱
难度: 中等查看答案及解析
-
已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是
A.分子中至少有12个碳原子处于同一平面上
B.分子中至少有10个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.该烃属于苯的同系物
难度: 中等查看答案及解析
-
某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于
A.原子晶体 B.离子晶体 C.分子晶体 D.金属晶体
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:
M(g) + N(g)
R(g) + 2L
此反应符合下图,下列叙述正确的是

A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是气体 D.正反应放热,L是固体或液体
难度: 中等查看答案及解析
-
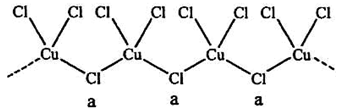
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析不正确的是
A.K3C60中既有离子键又有非极性键
B.1mol K3C60中含有的离子数目为63NA
C.该晶体在熔融状态下能导电
D.该物质的化学式不能写作KC20
难度: 中等查看答案及解析
-
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4混合物
分液漏斗、烧杯
Br2和CCl4混合物、蒸馏水
B
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、银氨溶液
C
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀HNO3
D
测定NaOH溶液浓度
滴定管、锥形瓶、烧杯
NaOH溶液,0.1000mol/L盐酸
难度: 中等查看答案及解析
-
常温下、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.c(NH3·H2O)/c(OH-) B.c(OH-)/c(NH3·H2O)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
难度: 中等查看答案及解析