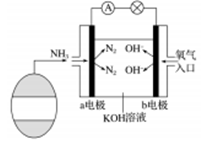
-
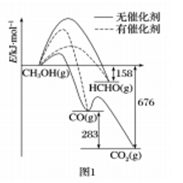
H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
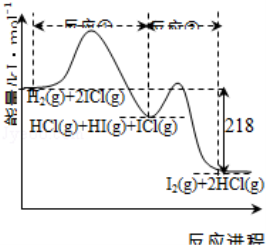
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为△H=﹣218kJ•mol﹣1
难度: 简单查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是
共价键
H—H
F—F
H—F
H—Cl
H—I
E/kJ/mol
436
157
568
432
298
A. 432 kJ /mol>E(H—Br)>298kJ/mol B. 表中最稳定的共价键是 H—F键
C. H2(g)→2H(g) △H=+436kJ/mol D. 1/2H2(g)+l/2F2(g)=HF(g) △H=-25kJ/mol
难度: 简单查看答案及解析
-
下面4种燃料电电的工作原理示意图,其中正极的反应物为水的是( )
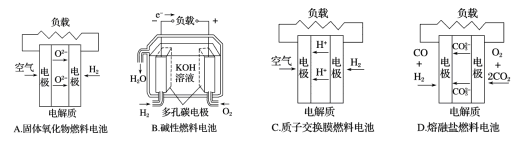
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
世博会中国馆,主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下有关叙述正确的是( )
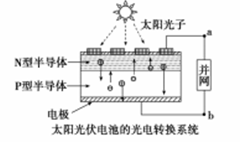
A. 光伏电池是将太阳能转变为电能 B. 光伏电池是将化学能转变为电能
C. 电流从a流向b D. 图中N型半导体为正极,P型半导体为负极
难度: 中等查看答案及解析
-
手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是
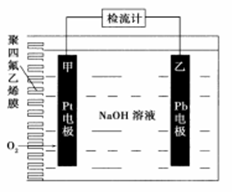
A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
难度: 中等查看答案及解析