-
几种短周期元素的原子半径及主要化合价如下表
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.水分子呈直线形,氨分子呈三角锥形
C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键
D.分子间作用力越大,分子的热稳定性就越大
难度: 中等查看答案及解析
-
下列关于能源和作为能源物质的叙述中不正确的是
A.人类利用的能源都是通过化学反应获得的
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热,反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.氯原子的结构示意图:
B.作为相对原子质量测定标准的碳原子:146 C
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
难度: 中等查看答案及解析
-
下列各组中,含有离子晶体、分子晶体、原子晶体各一种的是
A.KCl、 H2SO4 、S B.金刚石、NH4Cl、CH4
C.HF、 SiO2 、 Al D.金刚石、SiO2、Na2CO3
难度: 中等查看答案及解析
-
下列排列顺序不正确的是
A. 粒子半径:Al3+ < Mg2+ < F-
B. 热稳定性:HI > HBr > HCl > HF
C. 酸性: H2SiO3 < H3PO4 < H2SO4 < HClO4
D. 碱性: NaOH > Mg(OH)2 > Al(OH)3
难度: 中等查看答案及解析
-
和
是氧元素的两种同位素,
表示阿伏伽德罗常数,下列说法正确的是
A.
与
互为同分异构体
B.
与
核外电子排布方式不同
C.通过化学变化可以实现
与
间的相互转化
D.标准状况下,1.12L
和1.12L
均含有0.1
个氧原子
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,升高温度 D.压强不变充入N2使容器体积增大
难度: 中等查看答案及解析
-
足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的
A.NaNO3溶液 B.NaCl固体 C.水 D.CuSO4
难度: 中等查看答案及解析
-
反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s)③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为:
A.④>③>①>② B.②>④>③>①
C.②>③>④>① D.④>③>②>①
难度: 中等查看答案及解析
-
一定温度下,可逆反应2NO2
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;
⑤密闭容器中压强不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A.①④⑤⑥ B.②③⑤⑥ C.①③④⑥ D.全部
难度: 中等查看答案及解析
-
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是
A.N2H4+O2=N2+2H2O △H =-534.4kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.4kJ/mol
C. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = +534.4kJ/mol
D.
N2H4(g)+
O2(g)=
N2(g)+H2O(g)△H =-16.7kJ/mol
难度: 中等查看答案及解析
-
直接提供电能的反应一般是放热反应,下列反应中能提供电能的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
难度: 中等查看答案及解析
-
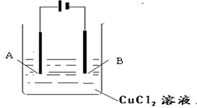
用石墨电极电解100 mL硫酸铜和硫酸的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),原混合溶液中Cu2+ 的物质的量浓度(mol·L-1)为
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
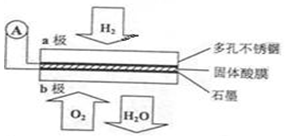
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
难度: 中等查看答案及解析
-
下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种可再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
难度: 中等查看答案及解析