-
胶体的最本质的特征是( )
A. 丁达尔效应 B. 可以通过滤纸
C. 布朗运动 D. 分散质颗粒的大小在1nm~100nm之间
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaOH溶液:K+、Ba2+、Cl-、HCO3-
B. 0.1 mol·L-1Na2CO3溶液:K+、NH4+、NO3-、SO42-
C. 0.1 mol·L-1FeCl3溶液:K+、Na+、I-、SCN-
D. 0.1 mol·L-1HCl的溶液:Ca2+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
NA 表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L CCl4 所含分子数约为NA 个
B.标准状况下,22.4 L乙醇中含有的氧原子数目为NA
C.1 mol NaHCO3晶体中含有阳离子数目为2NA
D.盛有SO2的密闭容器中含有NA个氧原子,则SO2 的物质的量为0.5 mol
难度: 中等查看答案及解析
-
对于反应3S+6KOH
2K2S+K2SO3+3H2O,下列说法正确的是( )
A. S是氧化剂,KOH是还原剂
B. 若3mol硫完全反应,则反应中共转移了4mol电子
C. 还原剂与氧化剂的质量比是2:1
D. 氧化产物和还原产物的物质的量之比为3:2
难度: 中等查看答案及解析
-
已知氧化性强弱顺序:Cl2> Br2> Fe3+>I2。下列反应不能发生的是( )
A. Br2+2I-= I2+2 Br- B. 2FeCl2+Cl2 = 2FeCl3
C. 2FeCl2+2HCl+I2 = 2FeCl3+2HI D. 2Fe3+ + 2I-= 2Fe2+ + I2
难度: 中等查看答案及解析
-
将0.2mol钠、镁、铝、 铁分别放入100m 1mol·L-1的盐酸中,产的气体体积比是(同温同压下)
A. 1:2:3:2 B. 6:3:2:3 C. 1:1:1:1 D. 2:1:1:1
难度: 中等查看答案及解析
-
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 烧碱溶液 C. 氨水 D. KSCN溶液
难度: 中等查看答案及解析
-
下列图示实验操作,能达到目的的是( )
A. 检验钾离子
 B. 干燥氯气
B. 干燥氯气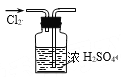 C. 分离酒精与水
C. 分离酒精与水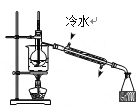 D. 蒸发食盐水
D. 蒸发食盐水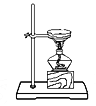
难度: 简单查看答案及解析
-
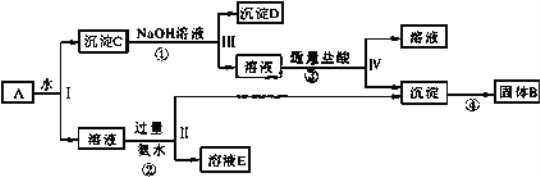
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A. Na+ B. Fe3+ C. Al3+ D. Fe2+
难度: 中等查看答案及解析
-
下列变化不可能通过一步反应直接完成的是( )
A. Al(OH)3→Al2O3 B. SiO2→H2SiO3
C. Al→AlO2﹣ D. NH3→NO
难度: 简单查看答案及解析
-
向含有FeCl3、BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤,向滤液中滴入KSCN溶液时无明显现象,由此得出的正确结论是
A. 白色沉淀是BaSO3 B. 白色沉淀是BaSO4
C. 白色沉淀是BaSO3、BaSO4的混合物 D. FeCl3全部被SO2氧化为FeCl2
难度: 简单查看答案及解析
-
下列有关实验操作、现象、解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热
小木条不燃烧
Na2SiO3 可作防
火剂
B
将 H2 在充满Cl2 的集气瓶中燃烧
集气瓶口上方有白烟生成
H2、Cl2 化合生成HCl
C
将 SO2 通入酸性高锰酸钾溶液中
溶液褪色
SO2 具有漂白性
D
除去表面氧化膜的铝箔,在酒精灯上充分加热
铝不能滴落下来
铝熔点高,没能熔化
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。综合上述实验,你认为以下结论正确的是
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,不含Cl-
B.该混合液中—定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+
D.该混合液中:c(K+) ≥ 0.1mol/L c(CO32-) = 0.1mol/L
难度: 困难查看答案及解析