-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
难度: 简单查看答案及解析
-
能说明醋酸是弱电解质的事实是
A. 醋酸溶液的导电性比盐酸弱
B. 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C. 醋酸溶液用水稀释后,氢离子浓度下降
D. 0.1mol·L-1的CH3COOH溶液中,氢离子的浓度约为0.001mol·L-1
难度: 简单查看答案及解析
-
温家宝指出“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是
A. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B. 加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
C. 研制开发以水代替有机溶剂的化工涂料
D. 将煤转化成气体燃料可以有效地减少“温室效应”的气体产生
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g);ΔH= -373.2 kJ/mol,达到平衡后,为提高该反应的速率和 NO 的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入 N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
下列变化属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A. ①④ B. ②③ C. ①④⑤ D. ②④
难度: 简单查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
C.向氯水中加CaCO3后,溶液漂白性增强
D.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用C表示的反应速率是0.2 mol/(L·min)
C. 2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
难度: 简单查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B. 太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少
D. 由3O2(g)=2O3(g) ΔH>0,可知臭氧比氧气的化学性质更活泼
难度: 中等查看答案及解析
-
高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)恒容时,温度升高,H2浓度减小.下列说法正确的是
A. 该反应的焓变为负值
B. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
C. 2CO2(g)+2H2(g)⇌2CO(g)+2H2O(g) 的平衡常数K1=K2
D. 若恒容、恒温下充入CO,则K值变大
难度: 中等查看答案及解析
-
电镀废液中Cr2O72—可通过下列反应转化成铬黄(PbCrO4):
Cr2O72—(aq)+2Pb2+(aq)+H2O(l)
2PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )

难度: 中等查看答案及解析
-
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是
A. v(A)=0.6mol/(L·min) B. v(B)=1.2mol/(L·min)
C. v(C)=1.2mol/(L·min) D. v(B)=0.03mol/(L·s)
难度: 简单查看答案及解析
-
在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)
2Z(g),此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内气体密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1molX同时生成0.2molZ
难度: 简单查看答案及解析
-
下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.由C(石墨) =C(金刚石) ΔH > 0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ/mol
难度: 中等查看答案及解析
-
下列物质中,能导电且属于电解质的是
A.乙醇 B.蔗糖 C.NaCl溶液 D.熔融态Na2CO3
难度: 简单查看答案及解析
-
已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )
A. C8H18(l) + O2(g)
8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1
B. C8H18(l) + O2(g)
8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l) + O2(g)
8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1
D. C8H18(l) + O2(g)
8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
难度: 简单查看答案及解析
-
在密闭容器中进行下列反应,M(g)+N(g)
R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应
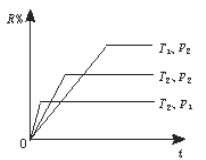
A. 正反应是吸热反应,L是气体
B. 正反应是放热反应,L是气体
C. 正反应是吸热反应,L是固体
D. 正反应是放热反应,L是固体或液体
难度: 中等查看答案及解析
-
下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是( )
纯净物
混合物
强电解质
弱电解质
非电解质
A
纯盐酸
水煤气
硫酸
醋酸
干冰
B
冰醋酸
空气
硫酸钡
亚硫酸
二氧化硫
C
氯气
盐酸
苛性钠
氢硫酸
碳酸钙
D
漂白粉
氨水
氯化钠
次氯酸
氯气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
反应Fe(s)+CO2(g)
FeO(s)+CO(g)在700℃时平衡常数为1.47,在900℃时平衡常数为2.15,下列说法正确的是( )
A. 升高温度,该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为
C. 该反应的正反应是吸热反应
D. 增大CO2浓度,平衡常数增大
难度: 中等查看答案及解析
-
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A. 加少量烧碱溶液 B. 降低温度 C. 加少量冰醋酸 D. 加水
难度: 中等查看答案及解析